Tas-eiwit (afb: McGoverninstituut/Max Wilkinson)


Tas-eiwit (afb: McGoverninstituut/Max Wilkinson)
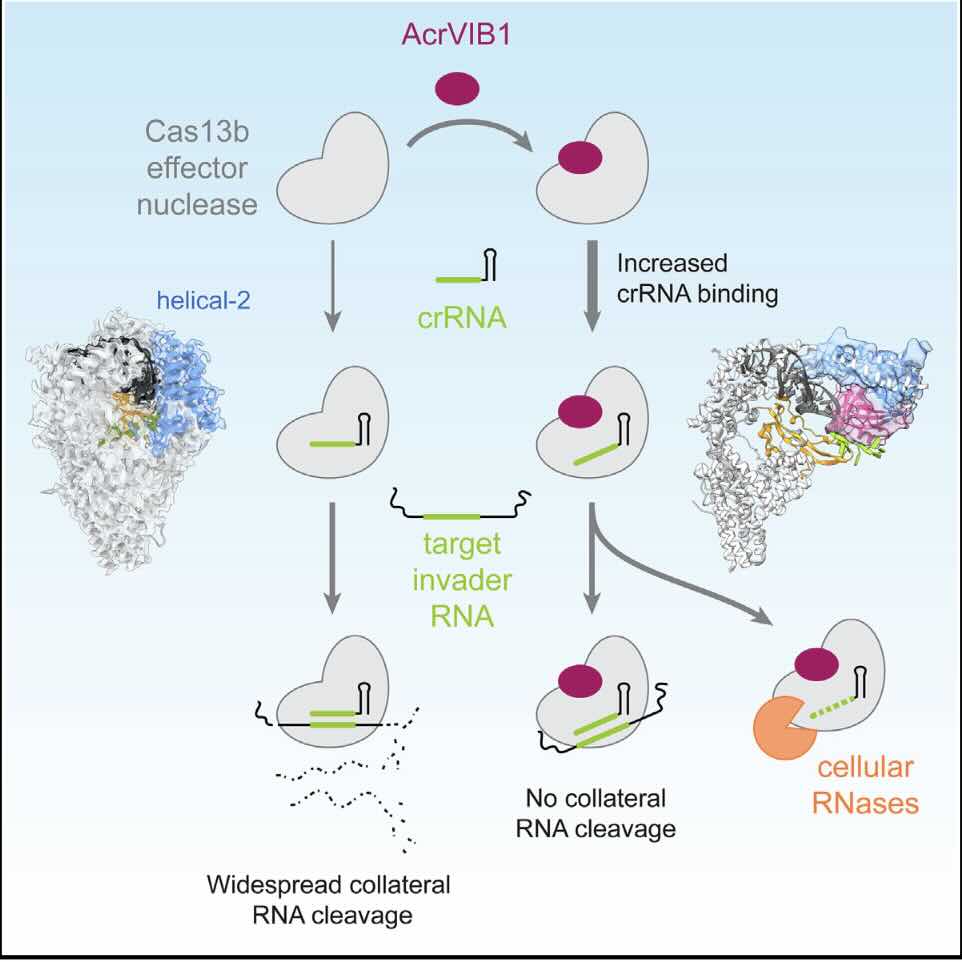
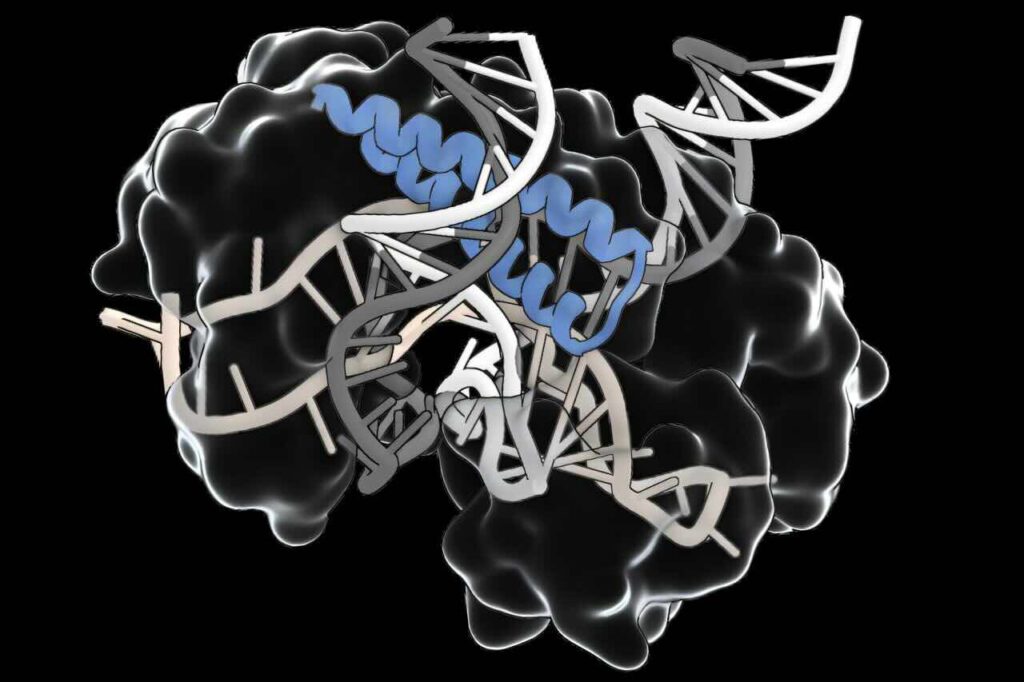
CRISPR-remmers geven meer ‘houvast’ bij genoombewerking (afb: Katherina Wandera et al./Molecular Cell)
De CRISPR/Cas-genschaar biedt een breed scala aan potentiële toepassingen, van de behandeling van genetische ziekten tot antivirale therapieën en diagnostiek. Om hun krachten echter veilig te benutten, zoeken wetenschappers nog steeds naar mechanismen die de activiteit van die systemen kunnen sturen. Het anti-CRISPR-eiwit AcrVIB1 is een veelbelovende remmer waarvan de exacte functie tot nu toe duister. Onderzoekersters van, onder meer, het Helmholtzinstituut voor RNA-besmetting HIRI in Würzburg hebben ontdekt hoe AcrVIB1 werkt (pdf-bestand), wat de mogelijkheden waarmee Acr’s CRISPR kunnen uitschakelen zijn toegenomen. Er liggen waarschijnlijk nog meer mogelijkheden braak. Lees verder

Toevoeging van tRNA bleek bakkersgist beter bestand tegen hogere temperaturen te maken (afb: Hugh Goold et al./Nature Communications)
Het schijnt gelukt te zijn om een geheel genoom van een gist te synthetiseren. Onderzoekers, of waarschijnlijk hun voorlichters, spreken dan meteen weer van een mijlpaal. Het zou voor het eerst zijn dat dat gelukt is voor eukaryoot (cellen die ook zoogdieren hebben). Het is het genoom van bakkersgist (Saccharomyces cerevisiae) waaraan een tRNA-chromosoom is toegevoegd. Lees verder

Xue (Sherry) Gao (afb: univ. van Penn)
Onderzoeksters van, onder meer, de universiteit van Pennsylvania hebben een genoombewerker gecombineerd met een ‘knop’ om de genactiviteit te veranderen. Daarmee zouden genen nauwkeurig zijn te bewerken terwijl tegelijkertijd ook de genexpressie (mate waarin gen actief is) kan worden veranderd. Die techniek zou zowel voor geneeskundige als voor onderzoeksdoelen kunnen worden ingezet, stellen de onderzoeksters. Lees verder

Jiankui He op genoomcongres in Hongkong in 2018
Veel erfelijke ziektes zijn het gevolg van mutaties op verschillende genen. Met de nieuwe methoden om het genoom te bewerken, groeit de hoop die fouten ooit te kunnen corrigeren met wat polygene genoombewerking heet. Op basis van recent onderzoek van Peter Visscher van de universiteit van Queensland en collega’s stellen de onderzoekers dat die polygene genoombewerking over enkele tientallen jaren tot de mogelijkheden gaat behoren, maar de redactie van het wetenschappelijke blad Nature vindt dat we daar eerst goed over moeten praten voor we daaraan gaan beginnen. Daar zijn Visscher c.s. het roerend mee eens. Lees verder
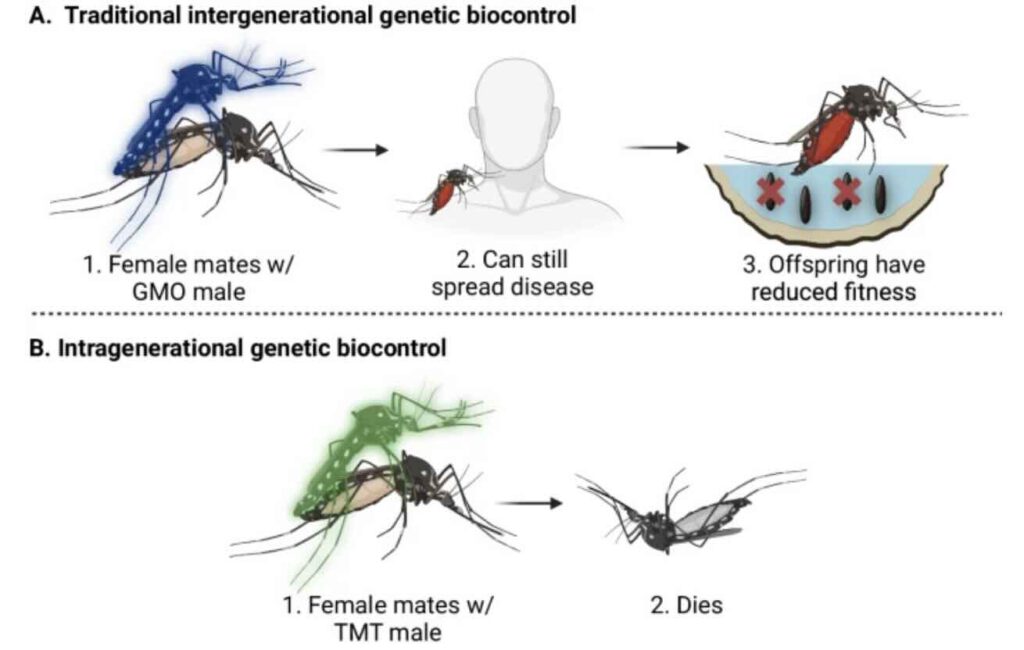
Mannetjes lozen hun giftige lading. Die methode zou effectiever zijn dan gendruk (boven) (afb: Samuel Beach et al./Nature Communications)
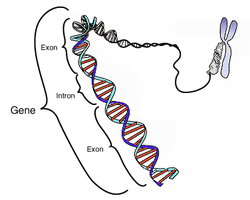
Een gen is opgebouwd uit exonen en intronen (afb: WikiMedia Commons)
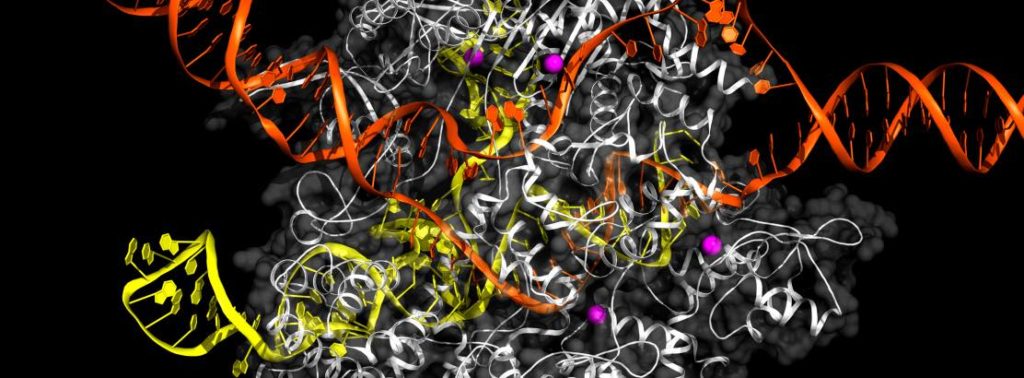
Het CRISPR/Cas9-complex aan het werk aan DNA (rood) (afb: univ. van Californië)
De CRISPR-methode om genetische fouten te repareren (of nieuwe functies te introducen) is ook in dit blog vaak ter sprake gekomen. De aanvankelijke hoerastemming is inmiddels wat geluwd, omdat die methode niet altijd even netjes (en dus onveilig) werkt. Er wordt verdurend gesleuteld aan het opschroeven van de effectiviteit (dus veiligheid) en het minimaliseren van onbedoelde veranderingen. Nu hebben onderzoekers van het befaamde ETH in Zürich aangetoond dat zo’n nieuwe, verfijnde methode allesbehalve veilig is. Toch blijven ze in de CRISPR-methode geloven als veilige manier om genetische mankementen te rapareren Lees verder
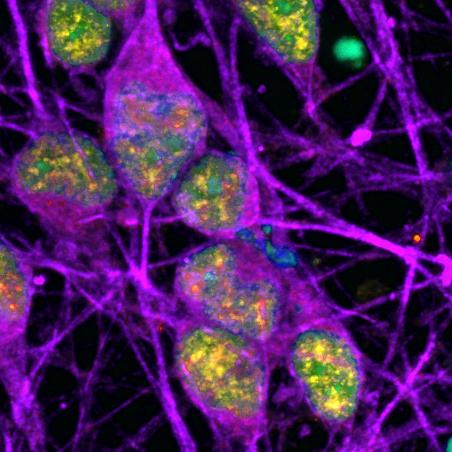
Hersencellen (paars) waar DNA-schade wordt gerepareerd (geel). DNA zelf is lichtblauw (cyaan), maar met geel wordt dat groen. (afb: Nussenzweig et al.)
Een cel heeft verschillende mechanismes om schade aan DNA te herstellen. Een groep van wetenschappers rond Kaspar Burger van de Julius-Maximilians-universiteit Würzburg (JMU) heeft nu een van deze signaalpaden wat nader bekeken. Ze zagen een nieuw mechanisme van de DNA-schaderespons dat gebruik maakt een RNA-transcript NEAT1. De resultaten helpen een beter zicht te krijgen op de manieren waarop cellen schade aan DNA herstellen en mogelijk ook de basis te leggen voor het ‘repareren’ van genetische ziektes. Lees verder
Cas9 is nogal ‘omvangrijk’ (afb: WkiMedia Commons)
CRISPR-Cas wordt wereldwijd gebruikt om genen in organismen te bewerken, in te voegen, te verwijderen of te reguleren. TnpB, een veel kleinere voorloper van de bekende ‘genschaar’ Cas-eiwitten, is gemakkelijker cellen te krijgen. Onderzoekers van, onder meer, de universiteit van Zürich hebben dat minder effectieve alternatief voor Cas-eiwitten nu verbeterd (met de onontkoombare ki) verbetert om een reëel alternatief te worden van die veel gebruikte maar erg ‘gewichtige’ Cas-eiwitten. Overigens lijkt de Chinese onderzoeker Guanghai Xiang daarin geslaagd te zijn door allerlei TnpB’s ‘door te lichten’ en daaruit de effectiefste twee heeft te kiezen: ISAam1 en ISYmu1