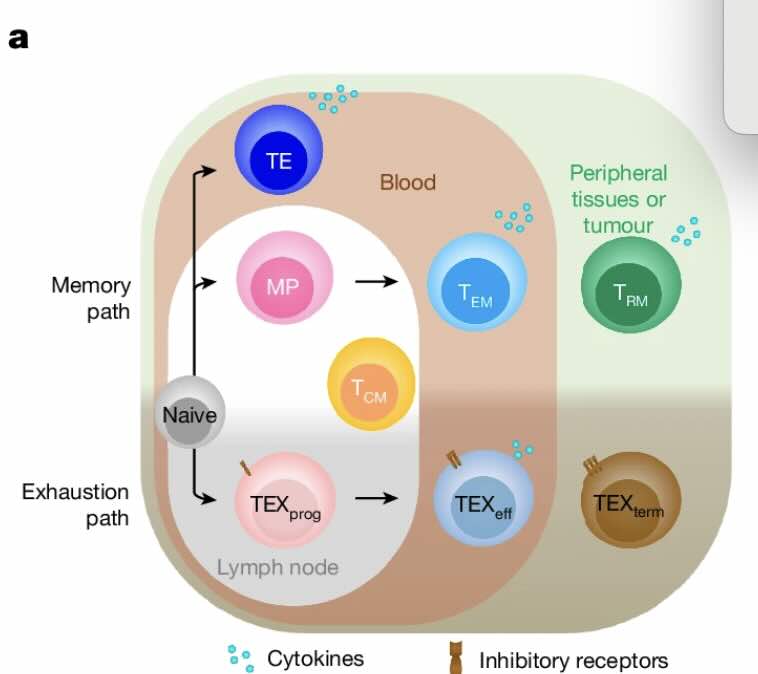
Cytotoxische T-cellen kunnen ‘uitgeput’ raken (vergrijsd deel), door te draaien aan twee ‘knoppen’ voor transcriptiefactoren herkregen ze hun dodelijke eigenschappen en ‘geheugen’ terug (bovenste deel) (afb: H. Kay Chung et al./Nature)
Ik(=as) weet niet of al die berichten die beloven de ‘oplossing’ tegen kankers(s) gevonden hebben nog wel het vermelden waard zijn. In mijn idee zijn de methodes om met, gene-tisch veranderde, afweercellen (vaak T-cellen) schier eindeloos. Nu komt me weer een bericht onder ogen dat onderzoeksters de ‘knop’ hebben ontdekt om ‘uitgeputte’ doder-T-cellen (ook cytotoxische T-cellen of CD8+-cellen genoemd) weer opgewekt kankercellen te laten ombrengen. Deze bevindingen zouden een lang bestaande aanname weerleggen dat afweeruitputting een onvermijdelijk gevolg is van langdurige immuunactiviteit.Ze brengen dan ook meteen in kaart welke genetische programma’s daarvoor kunnen worden ingezet. Een atlas, het zoiets dan. Lees verder