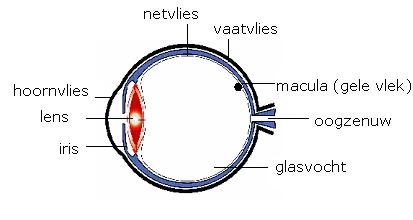
We hoeven niet meteen hoera te roepen, maar het zou kunnen zijn dat stamcellen in combinatie met chemotherapie een oplossing zou kunnen bieden aan reumalijders. Dat meldt de Duitse vereniging voor reumatologie (DGRh) als ‘smaakmaker’ voor het DGRh-congres, dat later deze maand zal worden gehouden in Mannheim en Heidelberg.
Reuma is een uiterst vervelende en pijnlijke auto-immuunziekte waar geen medicijn voor is. Hun leven lang moeten reumalijders pillen slikken om het leven dragelijk te houden, maar bij eenderde van de patiënten helpen de medicijnen niet die het op hol geslagen afweersysteem moeten onderdrukken. In Duitsland loopt een onderzoek bij 130 reumapatiënten om met behulp van stamcellen in combinatie met een chemotherapie het ‘geheugen’ van het afweersysteem te herinstellen, zodat dat zich niet meer keert tegen lichaamseigen stoffen. De resultaten tot nu toe worden ‘veelbelovend’ genoemd.
Bij auto-immuunziektes als reuma spelen zogeheten auto-antilichamen. Die veroorzaken de ellende. Het ligt dan ook in de rede het aantal daarvan te beperken. Dat gebeurt nu met behulp van medicijnen, maar, zoals gezegd, die slaan niet bij alle patiënten aan. De ware schuldigen zijn de plasmacellen in het beenmerg. Die hebben, kennelijk, een geheugen en maken voortdurend de verkeerde (=auto-) antilichamen aan.
Die plasmacellen uitschakelen lijkt dan een afdoende remedie. “Dat kan met behulp van chemotherapie”, stelt Falk Hiepe van het Berlijnse Charité-ziekenhuis. Daarmee zou het ‘afweergeheugen’ gewist worden, om in het in computertermen te houden, maar daarmee is de patiënt meteen ook weerloos tegen alle infecties waar hij tegenaan loopt. Dat ‘geheugen’ zou weer opnieuw moeten worden opgebouwd met behulp van stamcellen. Hiepe: “Het ziet er naar uit dat zich zo na het uitschakelen van het oude, foute afweergeheugen, weer een normaal functionerend immuunsysteem kan ontwikkelen. De patiënten hebben dan geen behandeling meer nodig.”
In Europa hebben al meer dan 1500 patiënten met autoimmuunziektes een stamcelbehandeling gehad. Bij tweederde daarvan verbeterde de situatie zich voor langere tijd en de meesten werden beter behandelbaar dan voor de stamceltransplantatie. Omdat het afweersysteem tijdelijk wordt platgelegd, is het infectiegevaar voor de patiënten groot. Daarom komen alleen mensen in aanmerking waarbij de afweeronderdrukkende medicijnen niet werken.
Er wordt onderzocht of er een alternatief voor de allesverwoestende chemotherapie is in de vorm van bortezomib, een medicijn dat wordt toegepast bij beenmergkanker. Dit middel schakelt de foutgeprogrammeerde geheugenplasmacellen maar voor de helft uit, die vervolgens weer snel worden aangemaakt. “We zoeken naar andere mogelijkheden om die plasmacellen efficiënt en gericht te vernietigen. Die dierproeven daarmee geven goede hoop”, stelt Hiepe in aanloop naar het DGRh-congres.
Bron: idw-online



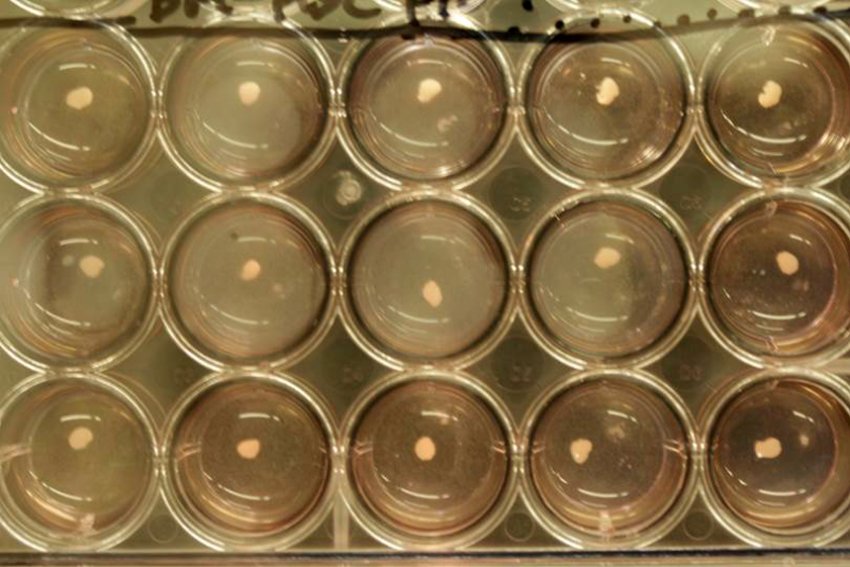 Petrischalen met leverweefsel: een staaltje zelforganisatie van de levercellen (foto Takanori Takebe )
Petrischalen met leverweefsel: een staaltje zelforganisatie van de levercellen (foto Takanori Takebe )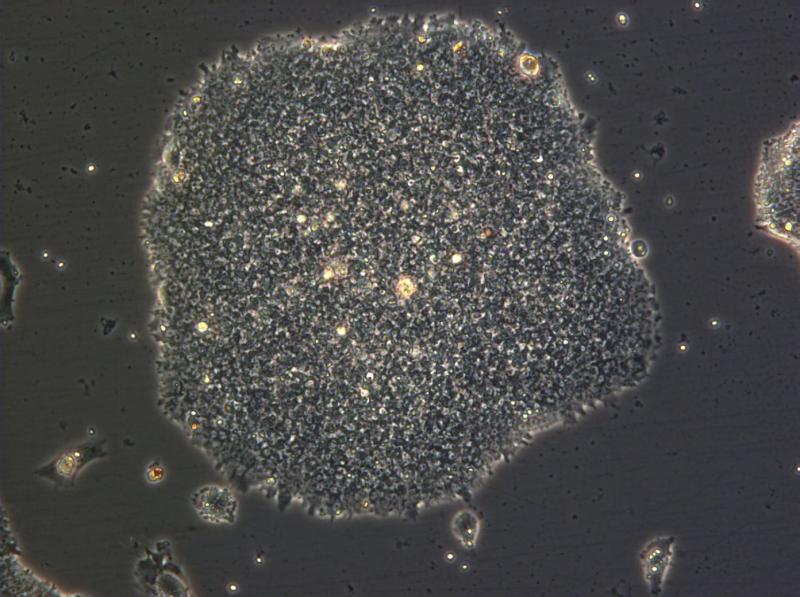 Een stamcelkolonie (100x vergroot). (foto: © Jonathan Göke/GIS)
Een stamcelkolonie (100x vergroot). (foto: © Jonathan Göke/GIS)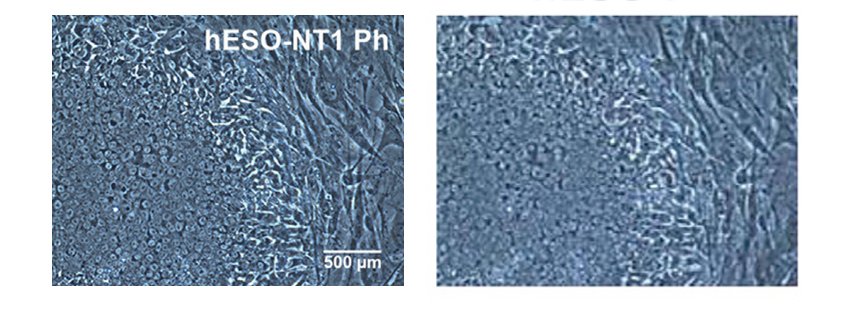 Links de cultuur van stamcellen die via klonen zou zijn ontwikkeld, rechts de op natuurlijke verkregen embryonale stamcellen (foto Der Spiegel).
Links de cultuur van stamcellen die via klonen zou zijn ontwikkeld, rechts de op natuurlijke verkregen embryonale stamcellen (foto Der Spiegel).