Onderzoekers van de universiteit van Oregon hebben een vaccin ontwikkeld waarmee het immunodefficiëntievirus bij apen (SIV) uit het lichaam verjaagd kan worden. De onderzoekers hopen binnenkort een verwant vaccin tegen HIV te kunnen testen.”Tot nu toe is maar een heel klein aantal patiënten genezen die met HIV waren besmet. Die kregen vrij snel na de besmetting anti-virusmedicijnen of kregen stamcellen om kanker te bestrijden”, zegt Louis Picker van het vaccin- en gentherapie-instituut van de universiteit. De resultaten doen veronderstellen dat ook HIV helemaal uit het lichaam kan worden verdreven.” Lees verder
Categorie archieven: Gentechnieken
Knipeiwit omgebouwd tot ‘genschakelaar’
Door een eiwit bedoeld om genen door te knippen, CRISPR-Cas, iets te veranderen knipt dat eiwit niet, maar zet genen op ‘actief’. Dat melden onderzoekers van het Amerikaanse Whitehead-instituut in het wetenschapsblad Cell Research.
De onderzoeksgroep, onder leiding van Rudolf Jaenisch, noemt het veranderende eiwit CRISPR-on. Het CRISPR-Cas-systeem, een aan het immuunsysteem van bacteriën ontleende genschaar, is tegenwoordig een populair onderzoeksthema, ook om dat dat kandidaat is voor de opvolging van de ‘aloude’ genschaar de zinkvingernucleases. In het CRISPR-Cas-eiwit is dat deel dat verantwoordelijk is voor het knipwerk (Cas9) een beetje veranderd met een domein dat gewoonlijk verantwoordelijk is voor de transcriptie van genen op het DNA naar mRNA. Het resultaat heet dCas9. De tweede component van het knipsysteem, een gespecialiseerd RNA-molecuul (sgRNA) dat normaal gesproken Cas9 naar het gewenste aangrijpingspunt in het DNA leidt, is ongewijzigd gebleven. Alleen is dat aangrijpingspunt nu de promotor van het gezochte gen. Het grote voordeel is volgens Jaenisch dat je voor al je experimenten maar één soort Cas9 nodig hebt. Om het aangrijpingspunt te veranderen hoef je alleen de basenvolgorde van je sgRNA maar aan te passen. De synthese daarvan is tegenwoordig geen probleem.
Je kunt zelfs verschillende sgRNA’s tegelijk inspuiten en zo het Cas9 laten ingrijpen bij een aantal genen tegelijk, waarbij je zelfs de verhouding tussen de expressieniveaus kunt instellen door van het ene sgRNA wat meer toe te voegen dan van het andere, aldus de onderzoeker. Hij heeft de techniek op muizen- en mensencelkweekjes uitgeprobeerd en ook op levende muizenembryo’s. In die celkweekjes heeft hij drie genen tegelijk aangezet. De onderzoekers vermoeden echter dat ze veel verder kunnen gaan en misschien wel mechanismen kunnen schakelen waarbij 10 of meer genen zijn betrokken. Waar de grens ligt, zal verder onderzoek moeten uitwijzen.
Bron: C2W
Succesvolle genmanipulator onder verdenking
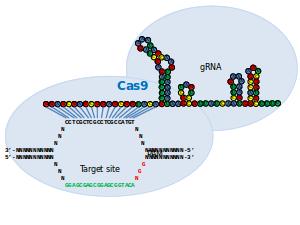
Synthetische biologie staat (en valt) met de vaardigheid het erfgoed te manipuleren (oneerbiedig gezegd: het knippen en plakken van genen). Synthetische eiwitten, zogeheten CRISPR Cas RGN’s, leken daarbij perfect gereedschap. Je kon, bij wijze van spreken, naar believen stukjes DNA op een bepaalde plek in het genoom plakken of het er uit verwijderen. Een truc die bacteriën gebruiken om virussen en andere ziekteverwekkers onschadelijk te maken.
Dat mooie gereedschap blijkt toch zijn kwalijke kantjes te hebben, zo blijkt uit onderzoek van een groep aan het algemeen ziekenhuis in Massachusetts. De plak-en-knip-eiwitten plakten niet alleen stukjes DNA op de beoogde plaatsen, maar ook elders. Dat betekent niet meteen dat dit mooie gereedschap in de vuilnisbak kan worden gegooid. “We zullen”, zei J. Keith Joung van het ziekenhuis, ” de methode moeten verfijnen.”
Het gereedschap bestaat uit een combinatie van instrumenten. Het enzym Cas9, de schaar, is gekoppeld aan een kort stukje RNA dat past op het beoogde stukje DNA. Zoals gezegd is de gentechniek ‘geleend’ van bacteriën. Die kopiëren stukjes genetische codes van virussen of andere indringers en plakken dat in hun eigen DNA. Als dezelfde indringer zich later weer meldt, wordt diens DNA, met behulp van Cas9 in combinatie met het in eigen DNA geplakte stukje genetische code, effectief onschadelijk gemaakt.
Sinds een jaar passen onderzoekers die methode nu toe op het erfgoed van fruitvliegjes, zebravissen, muizen en menselijke cellen. Deze techniek zou een stuk effectiever zijn dan andere technieken die worden gebruikt voor het veranderen van het erfgoed als zinkvingernucleases (ZFN’s) of transcriptie-activatorachtige effectornucleases (TALEN’s). RGN’s kunnen zo worden ‘geprogrammeerd’, dat ze op diverse plaatsen nieuwe stukjes DNA kunnen plakken.
Het ging volgens de onderzoekers niet alleen mis bij stukjes DNA die maar een paar nucleotiden verschillen van het beoogde stukje (dat zou je een ‘vergissing’ kunnen noemen), maar ook bij stukjes DNA die tot wel vijf nucleotiden verschilden van het stukje DNA dat in het genoom geplakt moest worden. Dat misplakken is niet waargenomen bij de andere genmanipulatietechnieken. Joung heeft er alle vertrouwen in dat de problemen met de RGN-techniek kunnen worden opgelost, zodat die ook kan worden gebruikt voor therapeutische doeleinden bij mensen.
Bron: Science Daily (plaatje addgene)
Hooggerechtshof VS verbiedt octrooiering natuurlijke genen
 De Amerikaanse opperrechter Clarence Thomas
De Amerikaanse opperrechter Clarence Thomas
Menselijke genen kunnen niet gepatenteerd worden. Dat heeft het Amerikaanse hooggerechtshof unaniem besloten. Kunstmatig gemaakte stukjes DNA zijn wél octrooieerbaar, stelde het hof. In Amerika was het, in tegenstelling tot Europa, al 30 jaar gebruikelijk om ook stukjes natuurlijk DNA te octrooieren. De zaak ging om patenten van een bedrijf uit Utah (Myriad Genetics, Salt Lake City) op genen die betrekking hadden op borst- en op baarmoederhalskanker. De Amerikaanse biotechnologische sector was zwaar in het geweer gekomen tegen een ban op DNA-patenten. Die zou grote investeringen in genonderzoek en in gentherapieën op losse schroeven zetten. Opperrechter Clarence Thomas betoogde dat een stuk DNA een product van de natuur is en niet patenteerbaar is omdat dat gen toevallig door de patentaanvrager geïsoleerd is.
Bron: BBC
Rekenen met DNA? Ik weet het niet.
Een groep onderzoekers aan de Stanford-universiteit rond Jerome Bonnet in Californië, met medewerking van de bekende synbioloog Drew Endy, heeft in Science beschreven hoe je met stukjes DNA in een bacterie logische schakelingen kunt maken. Dan gaat het om, zou je kunnen zeggen, de biologische variant van de zogeheten Booleaanse logica: de EN-, OF-, NEN-poorten enzovoorts. Meteen wordt er dan druk gespeculeerd over de ontwikkeling van de biologische computer, maar het ligt veel meer voor de hand dat deze schakelingen voor andere zaken zullen worden gebruikt, zoals voor diagnose (bijvoorbeeld bij kanker) of voor het induceren van bepaalde reacties (en dus maken van ‘producten’).
De onderzoekers noemen hun ‘biotransistors’ transcriptors en hun biologica BIL (Booleaanse integrase-logica; waarbij integrase een enzym is dat in de experimenten als ‘regelaar’ werd gebruikt). In de elektronica regelt een transistor de elektronenstroom, in de biologica doet de transcriptor dat met de ‘stroom’ (=werking) van een bepaald enzym; in de proefneming was dat RNA-polymerase, een enzym dat een rol speelt bij de transcriptie van DNA. Bonnet c.s. gebruikten een ander enzym (integrase dus) om de activiteit van RNA-polymerase langs de DNA-streng te reguleren (aan, uit te zetten). In de proefnemingen betekende dat er dan al of niet een groen fluorescerend eiwit (GFP) werd geproduceerd, een duidelijk zichtbare signaalstof die vaker wordt gebruikt om effecten van genactiviteit te controleren. Drew Endy vertelt zelf op YouTube hoe die biologica in elkaar steekt, maar daarmee wordt niet echt duidelijk hoe de onderzoekers te werk zijn gegaan.
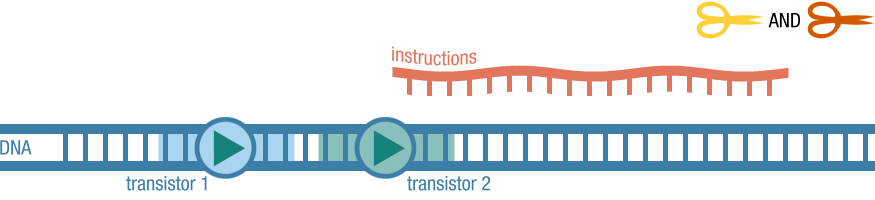
Op npr.org legt Geoff Brumfiel het, voor leken, wat beter uit. Het komt er op neer dat in een DNA-streng de transcriptor wordt ingebouwd. Als die transcriptor ‘dicht’ is, dan kan RNA-polymerase niet zijn transcriptiewerk doen, staat de transcriptor ‘open’, dan gebeurt dat wel en wordt er, dus, GFP geproduceerd. Door nu twee transcriptors achter elkaar te zetten, kan je, bijvoorbeeld, een EN-poort maken, waarbij elk van de transcriptors door een bepaalde stof wordt geregeld (de transcriptor wordt door de integrases losgeknipt en omgedraaid).
Bron: Cees Dekker
Onderzoekers lenen ‘genschakelaar’ van bacteriën
 Onderzoekers van de universiteit van Californië in San Fransisco hebben naar eigen zeggen een verfijndere manier gevonden om genen uit te schakelen. Het uitschakelen van genen wordt gebruikt in het onderzoek naar kanker en andere ziekten. Ook kan met deze, en soortgelijke, technieken een beter inzicht worden verkregen in het functioneren van het genetische systeem. De onderzoekers rond Wendell Lim leenden daarvoor een truc die bacteriën gebruiken om virussen te bestrijden, zo schrijven ze in het wetenschapblad Cell. De techniek wordt aangeduid met CRISPR-interferentie. Daarmee kan een aantal of afzonderlijke genen (tegelijkertijd) het zwijgen worden opgelegd.
Onderzoekers van de universiteit van Californië in San Fransisco hebben naar eigen zeggen een verfijndere manier gevonden om genen uit te schakelen. Het uitschakelen van genen wordt gebruikt in het onderzoek naar kanker en andere ziekten. Ook kan met deze, en soortgelijke, technieken een beter inzicht worden verkregen in het functioneren van het genetische systeem. De onderzoekers rond Wendell Lim leenden daarvoor een truc die bacteriën gebruiken om virussen te bestrijden, zo schrijven ze in het wetenschapblad Cell. De techniek wordt aangeduid met CRISPR-interferentie. Daarmee kan een aantal of afzonderlijke genen (tegelijkertijd) het zwijgen worden opgelegd.
Een jaar of tien geleden werd ontdekt hoe via het blokkeren van RNA de productie van bepaalde eiwitten kon worden voorkomen, de zogeheten RNA-interferentie. RNA-interferentie was goed voor een Nobelprijs. CRISPR-interferentie (een ‘onmogelijke’ afkorting voor clustered regularly interspaced short palindromic repeats: korte palindromische herhalingen van gegroepeerde regelmatige tussenruimtes; wat dat ook moge betekenen) werkt als een vaccin, waarbij het een stukje virus-DNA inbouwt. Zo kunnen bacteriën virussen herkennen en bestrijden. Waar bij RNA-interferentie het RNA wordt geblokkeerd, voorkomt het CRISPR-mechanisme dat dat RNA ‘geschreven’ wordt. Op die wijze kunnen cellen of, beter gezeg het DNA, ‘gereprogrammeerd’ worden. Lim doet onderzoek naar het effect van reprogrammeren van cellen bij het bestrijden van kanker.


