Synthetische biologie staat (en valt) met de vaardigheid het erfgoed te manipuleren (oneerbiedig gezegd: het knippen en plakken van genen). Synthetische eiwitten, zogeheten CRISPR Cas RGN’s, leken daarbij perfect gereedschap. Je kon, bij wijze van spreken, naar believen stukjes DNA op een bepaalde plek in het genoom plakken of het er uit verwijderen. Een truc die bacteriën gebruiken om virussen en andere ziekteverwekkers onschadelijk te maken.
Dat mooie gereedschap blijkt toch zijn kwalijke kantjes te hebben, zo blijkt uit onderzoek van een groep aan het algemeen ziekenhuis in Massachusetts. De plak-en-knip-eiwitten plakten niet alleen stukjes DNA op de beoogde plaatsen, maar ook elders. Dat betekent niet meteen dat dit mooie gereedschap in de vuilnisbak kan worden gegooid. “We zullen”, zei J. Keith Joung van het ziekenhuis, ” de methode moeten verfijnen.”
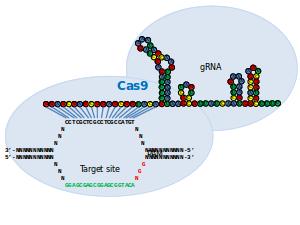
Het gereedschap bestaat uit een combinatie van instrumenten. Het enzym Cas9, de schaar, is gekoppeld aan een kort stukje RNA dat past op het beoogde stukje DNA. Zoals gezegd is de gentechniek ‘geleend’ van bacteriën. Die kopiëren stukjes genetische codes van virussen of andere indringers en plakken dat in hun eigen DNA. Als dezelfde indringer zich later weer meldt, wordt diens DNA, met behulp van Cas9 in combinatie met het in eigen DNA geplakte stukje genetische code, effectief onschadelijk gemaakt.
Sinds een jaar passen onderzoekers die methode nu toe op het erfgoed van fruitvliegjes, zebravissen, muizen en menselijke cellen. Deze techniek zou een stuk effectiever zijn dan andere technieken die worden gebruikt voor het veranderen van het erfgoed als zinkvingernucleases (ZFN’s) of transcriptie-activatorachtige effectornucleases (TALEN’s). RGN’s kunnen zo worden ‘geprogrammeerd’, dat ze op diverse plaatsen nieuwe stukjes DNA kunnen plakken.
Het ging volgens de onderzoekers niet alleen mis bij stukjes DNA die maar een paar nucleotiden verschillen van het beoogde stukje (dat zou je een ‘vergissing’ kunnen noemen), maar ook bij stukjes DNA die tot wel vijf nucleotiden verschilden van het stukje DNA dat in het genoom geplakt moest worden. Dat misplakken is niet waargenomen bij de andere genmanipulatietechnieken. Joung heeft er alle vertrouwen in dat de problemen met de RGN-techniek kunnen worden opgelost, zodat die ook kan worden gebruikt voor therapeutische doeleinden bij mensen.
Bron: Science Daily (plaatje addgene)


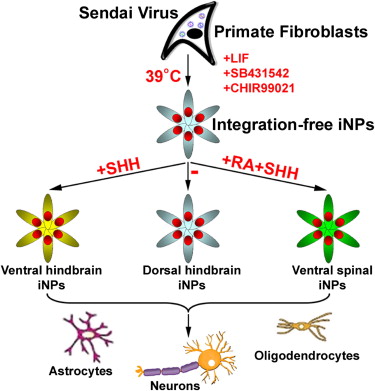 Onderzoekers van de universiteit van Wisconsin hebben bindweefselcellen (fibroblasten) omgetoverd tot
Onderzoekers van de universiteit van Wisconsin hebben bindweefselcellen (fibroblasten) omgetoverd tot  Brummelkamp en zijn medewerkers onderzoeken ook hoe virussen en bacteriën zich een weg banen in cellen, waarbij ze er achter proberen te komen welke eiwitten verantwoordelijk zijn voor het ‘binnenlaten’ van de ziekteverwekkers in de cel. Uit dit onderzoek kwam, onder meer, naar voren dat het beruchte
Brummelkamp en zijn medewerkers onderzoeken ook hoe virussen en bacteriën zich een weg banen in cellen, waarbij ze er achter proberen te komen welke eiwitten verantwoordelijk zijn voor het ‘binnenlaten’ van de ziekteverwekkers in de cel. Uit dit onderzoek kwam, onder meer, naar voren dat het beruchte