 Ons afweersysteem is een mooi systeem, maar soms zou je willen dat het niet werkte. Mensen met een transplantaten moeten afweerremmende medicijnen slikken en sommige medicijnen worden bestookt door ons defensiesysteem. Of soms is ons afweersysteem in de war en dan keert het zich tegen het eigen lijf zoals bij reuma.
Ons afweersysteem is een mooi systeem, maar soms zou je willen dat het niet werkte. Mensen met een transplantaten moeten afweerremmende medicijnen slikken en sommige medicijnen worden bestookt door ons defensiesysteem. Of soms is ons afweersysteem in de war en dan keert het zich tegen het eigen lijf zoals bij reuma.
Dat hele afweersysteem lamleggen is niet zo’n goed idee, maar in bepaalde gevallen, zoals bij transplantaties, ontkom je daar niet aan. Wat zou het niet aardig zijn als je alleen dat stukje van het afweersysteem zou uitschakelen dat voor ‘moeilijkheden’ zorgt (kan zorgen).
Precies dat hebben onderzoekers van het Amerikaanse Scripps-instituut gedaan. Ze slaagden er in bij hemofiele muizen de afweer tegen een toegediende stollingsfactor (factor VIII) uit te schakelen, terwijl het immuunsysteem overigens intact bleef. Bij hemofilie (bloederziekte) ontbreken bepaalde eiwitten (stollingsfactoren) die er voor moeten zorgen dat bij verwonding het bloed stolt. Hemofiliepatiënten krijgen die stollingsfactoren toegediend, maar bij zo’n 20 tot 30% maakt het afweersysteem die vreemde indringers weer onklaar.
De onderzoekers, onder aanvoering van James Paulson, maakten daarbij gebruik van de bijzondere kernmerken van de zogeheten B-cellen, die een belangrijke rol spelen in het afweermechanisme van ons lichaam. B-cellen, behorend tot de witte bloedlichaampjes of lymfocyten, zijn er in vele soorten en maten. Zo’n gespecialiseerde cel reageert op een heel specifiek antigeen (elke stof die een afweerreactie oproept) en zorgt er vervolgens voor dat het antilichaam wordt aangemaakt dat het antigeen onschadelijk maakt. Daarnaast bezit zo’n B-cel een receptor die in de aanwezigheid van een bepaald molecuul er voor zorgt dat de B-cel sterft. Dat alles is bedoeld om er voor te zorgen dat het afweersysteem maat houdt.
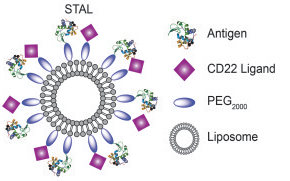
Van die laatste mogelijkheid hebben de TRSI-onderzoekers gebruik gemaakt. De stof die de celdood in gang zet bij die specifieke factor VIII-B-cellen is glycan, een soort suiker. Dat gebeurt wanneer glycan koppelt aan de receptor (CD22 in het plaatje). Door de hemofiele muizen nu nanodeeltjes toe te dienen waarin zowel glycan als de stollingsfactor VIII zitten, bleken ze die factor VIII-B-cellen uit te schakelen die zich anders tegen de vreemde stof zou hebben gekeerd. De toediening van de nanodeeltjes zorgde er ook voor dat het effect (het niet afstoten van factor VIII) maanden aanhield en mogelijk permanent zou kunnen worden.
Deze, wat genoemd wordt, liposomale nanodeeltjes zijn, voor andere toepassingen, al goedgekeurde door het Amerikaanse geneesmiddelenagentschap FDA, zodat klinische proeven bij mensen wat minder problematisch zullen zijn dan zonder die goedkeuring. De onderzoeksgroep gaat nu uitzoeken of deze techniek ook kan worden gebruikt bij transplantaties of bij autoimmuunziektes als multiple sclerose. “We weten dat die zaken ingewikkeld zijn, maar onze techniek zou, in combinatie met anderen, kunnen helpen.”, zei Paulson.
Bron: Science Daily (plaatje uit artikel in J.Clin.Inv.)



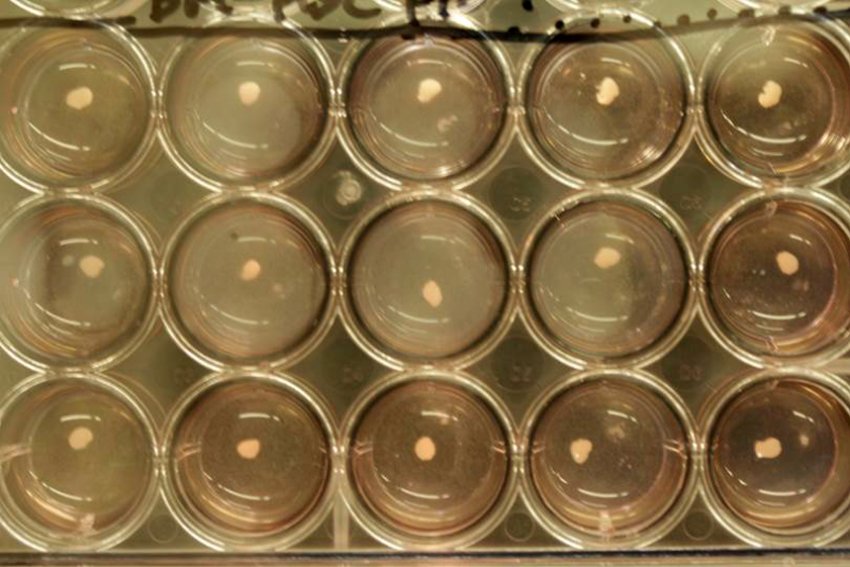 Petrischalen met leverweefsel: een staaltje zelforganisatie van de levercellen (foto Takanori Takebe )
Petrischalen met leverweefsel: een staaltje zelforganisatie van de levercellen (foto Takanori Takebe )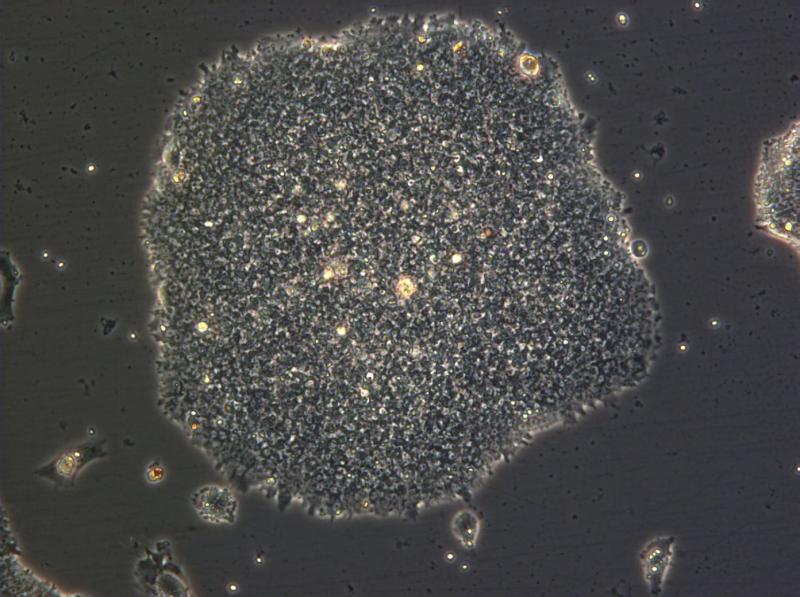 Een stamcelkolonie (100x vergroot). (foto: © Jonathan Göke/GIS)
Een stamcelkolonie (100x vergroot). (foto: © Jonathan Göke/GIS)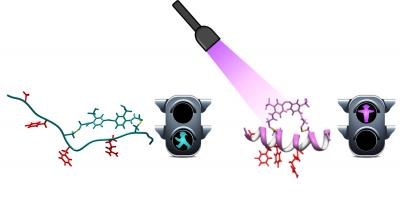 Onderzoekers van een aantal Catalaanse instituten hebben peptiden (relatief korte stukjes eiwit) gemaakt die onder invloed van licht van een bepaalde golflengte
Onderzoekers van een aantal Catalaanse instituten hebben peptiden (relatief korte stukjes eiwit) gemaakt die onder invloed van licht van een bepaalde golflengte 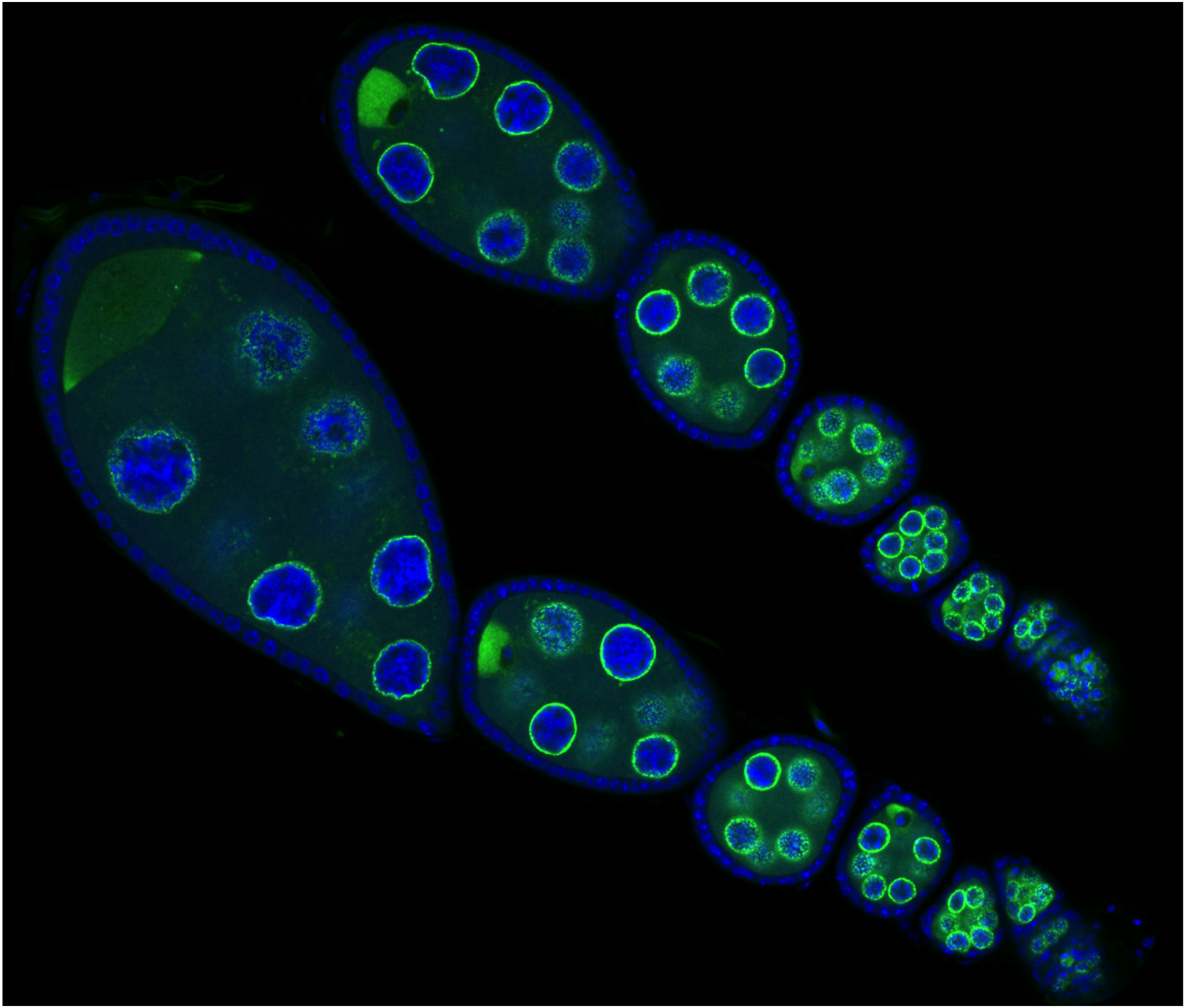 Eierstokken van een fruitvliegje. De eiwitten die een rol spelen in de piRNA-route zijn groen, DNA blauw (foto IMBA)
Eierstokken van een fruitvliegje. De eiwitten die een rol spelen in de piRNA-route zijn groen, DNA blauw (foto IMBA) Ons
Ons