Niet zodra kreeg de mens enig zicht op hoe de erfelijkheid in elkaar steekt of de wens kwam naar boven om die lieve schattige mammoet weer tot leven te wekken. Dat is vrij problematisch, omdat we maar kleine stukjes en beetjes van het erfelijk materiaal van deze oerolifant vinden als er weer ergens zo’n beest uit het ijs wordt gebikt. DNA is organisch materiaal en dat overleeft niet intact duizenden jaren; zelfs niet in de permafrost. De hoop tot de ‘herleving’ van de mammoet krijgt weer voeding, door de vondst begin mei van een, wat Der Spiegel noemt, verbazingwekkend goed geconserveerd mammoetkadaver.
Het mammoetlijk was zo goed geconserveerd dat er nog bloed in kon worden aangetroffen. Niet eerder was er een mammoet ontdekt die nog zo ‘intact’ was. Het gaat om een vrouwtje dat zo’n 10, 15 000 jaar geleden op een leeftijd van 60 jaar het leven gaf. Niet alleen bevatte het kadaver bloed, maar ook spierweefsel; volgens de Russen “rood als vers vlees”. Russische onderzoekers willen de mammoet tot leven klonen met behulp van, hopen zij, goed bewaarde cellen.

Expeditieleider Semjon Grigorjev, die werkt aan de staatsuniversiteit in Jakoetsk, had ooit connecties met de gevallen Zuid-Koreaanse kloon-ster Hwang Woo Suk, die meermalen aankondigde mammoets te zullen klonen, maar in het voorjaar vorig jaar maakte de Russische academie van wetenschappen bekend met hem te hebben gebroken.
Toen in 2008 het erfelijk materiaal van de mammoet uit al die gevonden stukjes en beetjes voor een groot deel was gereconstrueerd, leefde al het idee om een mammoet te klonen, maar destijds achtte het wetenschapsblad Nature de slaagkans gering. Om het beest weer tot leven te wekken heb je eicellen nodig. Die heb je niet, dus zou je eicellen van olifanten moeten gebruiken waar de kern uit wordt gehaald en vervangen door een mammoetkern, die je dan uit een van de intacte mammoetcellen zou moeten halen. Of zich daar een volbloed mammoet uit ontwikkelt is onwaarschijnlijk. Een eicel bevat niet alleen kern-DNA, maar ook mitochondriaal DNA en die is weer van de donor, de olifant.
Bron: Der Spiegel (foto Der Spiegel

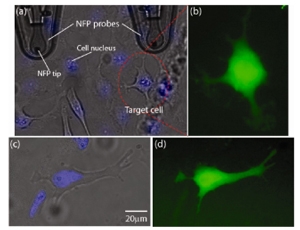
 Stamcellen zijn heftig in. Was gister te
Stamcellen zijn heftig in. Was gister te 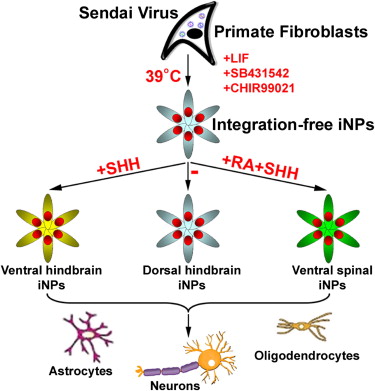 Onderzoekers van de universiteit van Wisconsin hebben bindweefselcellen (fibroblasten) omgetoverd tot
Onderzoekers van de universiteit van Wisconsin hebben bindweefselcellen (fibroblasten) omgetoverd tot  In het academisch ziekenhuis van de Harvard-universiteit (Massachusets) hebben onderzoekers een van levende cellen ontdane nier van een rat
In het academisch ziekenhuis van de Harvard-universiteit (Massachusets) hebben onderzoekers een van levende cellen ontdane nier van een rat  Je kunt een schadelijke bacterie bestrijden, maar je kunt ook de bedreiging onschadelijk maken. Er zijn nogal wat bacteriën die schade aanrichten door gif te produceren. Ook bij slangenbeten of wespensteken is het gebruikte gif de boosdoener. Bij de universiteit van Californië hebben onderzoekers een oplossing bedacht door dat probleem direct bij de horens te vatten: vang dat gif weg met nepbloedcellen. Die ‘cellen’ leveren hun giftige lading vervolgens af bij de lever, waar gif en nepbloedcellen onschadelijk worden gemaakt.
Je kunt een schadelijke bacterie bestrijden, maar je kunt ook de bedreiging onschadelijk maken. Er zijn nogal wat bacteriën die schade aanrichten door gif te produceren. Ook bij slangenbeten of wespensteken is het gebruikte gif de boosdoener. Bij de universiteit van Californië hebben onderzoekers een oplossing bedacht door dat probleem direct bij de horens te vatten: vang dat gif weg met nepbloedcellen. Die ‘cellen’ leveren hun giftige lading vervolgens af bij de lever, waar gif en nepbloedcellen onschadelijk worden gemaakt. “In plaats van dat we voor elk gif met een speciale therapie moeten behandelen, kunnen nu een breed scala aan toxines bestrijden”, zegt onderzoeksleider
“In plaats van dat we voor elk gif met een speciale therapie moeten behandelen, kunnen nu een breed scala aan toxines bestrijden”, zegt onderzoeksleider 
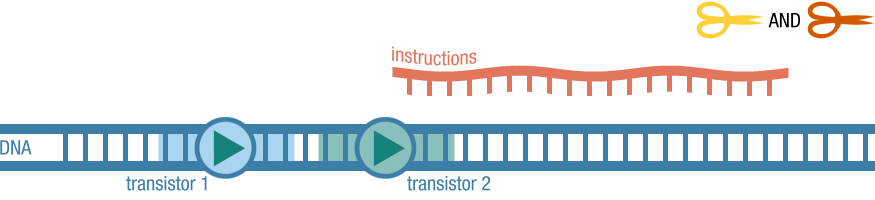
 Het is natuurlijk al vaker vertoond, onderzoekers die hoop geven op een doorbraak in de bestrijding van kanker en en passant ook maar meteen van die ziekte van Alzheimer en andere hersenaandoeningen, maar het moet er eens van komen. Medewerkers van het
Het is natuurlijk al vaker vertoond, onderzoekers die hoop geven op een doorbraak in de bestrijding van kanker en en passant ook maar meteen van die ziekte van Alzheimer en andere hersenaandoeningen, maar het moet er eens van komen. Medewerkers van het