
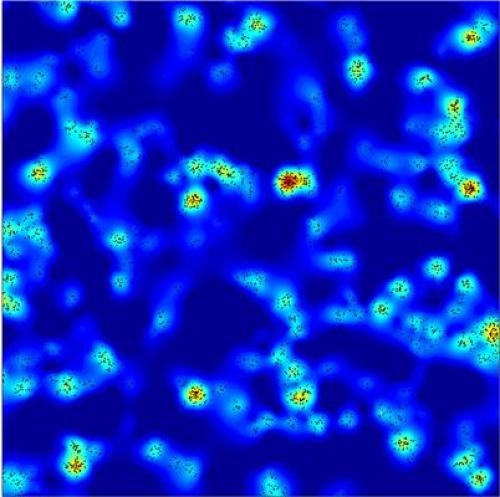
De gelabelde celonderdelen. Groen zijn de microtubuli, paars de mitochondriën, rood het Golgi-apparaat en geel de peroxisomen.
Met een lichtmicros-coop ben je beperkt door de kleinste golflengte van het zichtbare licht (de brekings- of diffractie-limiet). Die geeft de ondergrens aan van het oplossend vermogen van een lichtmicros-coop. Dat oplossend vermogen (resolutie) ligt op de helft van die golflengte (400 nm) en is, theoretisch, dus 200 nm (of je die resolutie haalt heeft ook iets met de gebruikte optiek te maken). Onderzoekers van het Wyss-instituut van de Harvard-universiteit hebben een truc bedacht om die ondergrens te doorbreken. Met behulp van stukjes DNA waaraan fluorescerende ‘vlaggen’ waren gehangen konden ze de fijne details in een cel laten zien met een resolutie van 10 nm. Lees verder



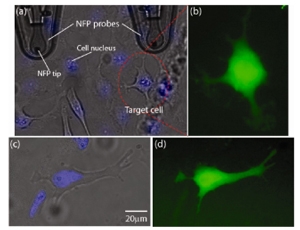
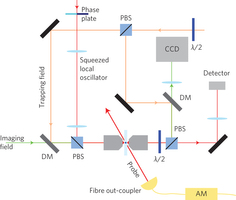 Het is niet goed mogelijk om met een microscoop in een levende cel te kijken. Foto’s van cellen zijn (vrijwel) altijd opnames van dode cellen, meestal gemaakt met een rasterelektronenmicroscoop. Althans, dat was zo. Australische onderzoekers van de universiteit van Queensland, onder aanvoering van
Het is niet goed mogelijk om met een microscoop in een levende cel te kijken. Foto’s van cellen zijn (vrijwel) altijd opnames van dode cellen, meestal gemaakt met een rasterelektronenmicroscoop. Althans, dat was zo. Australische onderzoekers van de universiteit van Queensland, onder aanvoering van