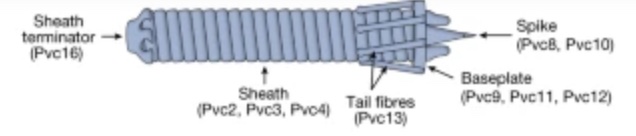
De bacteriële spuit, door de onderzoekers PVc gedoopt. Aan de rechter kant met de naald(‘spike’) zitten ook de staartvezels (’tail fibres’) De lading (eiwitten e.d.) komen links terecht (afb: F. Zhang et. al)
Vaak worden er lam gemaakte virussen gebruikt om allerlei ‘spullen’ in cellen af te leveren, zoals CRISPR-gereedschap, maar ditmaal leenden de onderzoekers een methode van bacteriën om eiwitten in (menselijke) cellen te spuiten. Daartoe hebben sommige bacteriën en groot molecuul dat fungeert als een soort injectienaald en onmiddellijk hebben onderzoekers het dan weer over een ‘doorbraak’ (van het celmembraan misschien). De ‘spuit’ zou, met enige veranderingen, ook kunnen fungeren om het werk van die lamme virussen over te nemen, denken de onderzoekers.
De CRISPR-methode wordt enigszins dwarsgezeten door het ontbreken van de juiste ‘bezorgers’, systemen die het vaak omvangrijke CRISPR-materiaal de cellen binnen kunnen loodsen. “Een van de belangrijkste knelpunten voor genoombewerking is de ‘bezorging'”, zegt Feng Zhang van het Broadinstituut.
Zo zouden klinische proeven met de bewerking van het genoom in levercellen en bloedcellen wel mogelijk zijn geweest, maar niet voor bijvoorbeeld hersen- en niercellen, stelt Zhang.
Hij ging met wat collega’s op zoek naar een alternatieve manier om eiwitten in menselijke cellen te krijgen. Zo bleken er bepaalde bacteriën te zijn die naaldmoleculen gebruikten om juist dat te doen. Met die naald maken ze een gat in het membraan van de cel waardoor de eiwitten de cel binnen konden worden gebracht.
Vorig jaar konden Feng Jiang, die ook aan dit onderzoek meedeed, en collega’s melden dat ze een manier hadden gevonden om de spuit van de lichtgevende bacterie Photorhabdus asymbiotica te gebruiken om daar cellen van zoogdieren, planten en schimmels mee te ‘bestoken’.
Normaal leeft die bacterie in wormpjes (nematoden) en gebruikt de spuit om gif in insecten te spuiten die die door de wormpjes besmet zijn. Het gif doodt het insect en het wormpje eet de resten op. De bacterie fungeert als een soort huurmoordenaar. Wat die daaraan heeft vertelt het verhaal niet.
De onderzoekers bewerkten de spuit van de P. asymbiotica om ervoor te zorgen dat die menselijke cellen ‘herkende’. Daarbij richtte ze zich op staartvezel van de spuit dat aan een insecteneiwit bindt. Daarbij gebruikten ze het programma Alphafold, dat de vorm van eiwitten heel aardig kan voorspellen. Toen ze het idee hadden hoe die verandering eruit moest zien bleek het veranderen van de bindingsplaats niet een al te groot probleem te zijn.
Cas9
De veranderde spuit werd uitgeprobeerd met allerlei eiwitten waaronder het inmiddels welbekende Cas9, de genschaar in de CRISPR-methode, maar ook met gif om kankercellen te doden. Die werden bezorgd bij mensencellen (in een kweek) en bij hersencellen van muisjes (daarvoor moest het bindingsdeel van de spuit wel worden aangepast voor muisjes). De spuit werd direct in hun hersentjes gespoten. Die leverde daar een fluorescerend eiwit af.
Het lukte niet het gids-RNA voor de CRISPR-methode te injecteren. Die moet de genschaar naar de goede plek op het DNA leiden. Er wordt aan gewerkt om dat toch voor elkaar te krijgen, maar medeonderzoeker Joseph Kreitz is niet ontevreden. Cas9 is vijf keer groter dan wat de spuit normaal in de cel injecteert.
Die spuit zelf zou overigens al zo groot zijn, dat die problemen zou opleveren in dichte tumoren. Ook zijn niet alle kankercellen aan de buitenkant te onderscheiden van gezonde cellen, zodat dat ook een probleem kan vormen de bacteriële spuit tegen kanker in te zetten.
Kreitz gaat ervan uit dat deze ‘mankementen’ verholpen kunnen worden. Zo zouden behalve eiwitten ook andere biomoleculen kunnen worden afgeleverd (al werkte dat niet bij gids-RNA voor de CRISPR-methode). “We hebben aangetoond dat deze systemen ongelooflijk veelzijdig zijn.(…) We geloven dat die een zeer belangrijke rol gaan spelen in de biologie maar die moeten nog verder onderzocht worden.”
