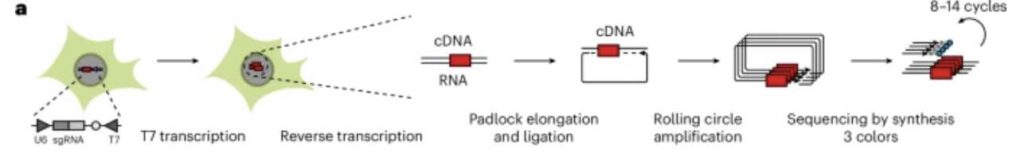
Zo werkt NIS-Seq. T7 zou dan de faagpromotor zijn (afb: Jonathan Schmid-Burgk et al./Nature Biotechnology)
Nee, dat doen ze normaal niet, maar onderzoekers van de universiteit van Bonn hebben een proces ontwikkeld dat het makkelijker maakt te achterhalen welke genen bij bepaalde ziektes (of welk biologisch proces ook) zijn betrokken. Daar zijn. natuurlijk ook andere methoden voor, maar deze methode, NIS-Seq gedoopt, zou snel en gemakkelijk zijn om bij vrijwel elk biologisch proces te achterhalen welke genen actief zijn.
Mensen hebben ongeveer 20 000 genen. Die bepalen hoe ons lichaam functioneert, hoe we ons ontwikkelen en hoe cellen zich voortplanten. “Bepaalde genen zijn bijvoorbeeld verantwoordelijk voor vitale afweerreacties, maar zijn ook betrokken bij levensbedreigende ontstekingsprocessen”, zegt Jonathan Schmid-Burgk, werkgroepleider bij het Instituut voor Klinische Chemie en Klinische Farmacologie aan het Bonner academisch ziekenhuis.”Onze onderzoeksinteresse is om deze genen te identificeren om ziekten beter te kunnen behandelen.”
De gebruikelijke methode hiervoor is om met de CRISPR-methode de functie van alle genen te onderzoeken stelt Schmid-Burgk uit. Die ‘genschaar’ gebruik je om de functie van genen te achterhalen. Schmid-Burgk: “Dit proces is uiterst complex. Voor elk proces heb je een aparte methode nodig om cellen waar in een bepaald biologisch proces verloopt te vermeerderen, bijvoorbeeld met behulp van celsorteermachines. Nog een zwak punt is dat de CRISPR-screening niet in elk celtype werkt. Vooral de interessante menselijke afweercellen overleven het meerfasige proces vaak niet.”
Ik(=as) wil hier even, heel eigenwijs, inbreken. Je kunt natuurlijk ook in cellen het RNA-bestand ‘lezen’ om te zien welke genen er actief zijn, maar dat zeg ik als totale leek en ik besef dat dat ook vrij arbeidsintensief kan zijn.
De onderzoekers uit Bonn hebben nu een nieuw optische CRISPR-methode ontwikkeld waarmee belangrijke genen veel gemakkelijker en sneller kunnen worden geïdentificeerd: Nuclear In-Situ Sequencing, kortweg NIS-Seq. “Ook hier wordt CRISPR/Cas (Cas is de feitelijke ‘genschaar’ as) gebruikt”, legt medeonderzoekster en hoofdauteur Caroline Fandrey uit. “We kunnen echter vrijwel elk biologisch proces in cellen observeren terwijl ze nog leven, om zo de belangrijkste betrokken genen te identificeren.”
De onderzoekers gebruiken een truc. Naast het gids-RNA om de ‘schaar’ naar de juiste plek te leiden gebruikten een stukje DNA van een bacteriofaag (bacterievirus): de promotor. Die zorgt er voor dat de uitgekozen stukken DNA worden vermenigvuldigd en gaan ‘gloeien’, staat er in het persbericht, maar dat doe DNA-stukjes niet van zichzelf. Daarvoor zou je er een lichtgevend eiwit aan moeten hangen. Die kun je bekijken met een fluorescentie ze een standaard fluorescentiemicroscoop om te zien welk gen is uitgeschakeld. En dan moet je nog 19 999 genen.
“Met NIS-Seq hebben we momenteel ongeveer een week nodig om een relevant gen te identificeren”, zegt co-hoofdauteur Marius Jentzsch . “Bij een conventioneel CRISPR-onderzoek duurt het vaak maanden om de cellen netjes te scheiden op basis van hun functie.”
Nog een voordeel van de nieuwe methode: het werkt met vrijwel alle cellen, zelfs met bijzonder kleine of inactieve cellen – op voorwaarde dat ze een celkern hebben. In de studie analyseerden de onderzoekers met succes acht celtypen van twee soorten. Schmid-Burgk: “Wij zijn ervan overtuigd dat onze methode de nieuwe standaard zal worden voor de bepaling van de belangrijke genetische spelers in celprocessen.” Tja. Mij(=totale leek) valt het een beetje tegen.
Bron: idw-online.de
