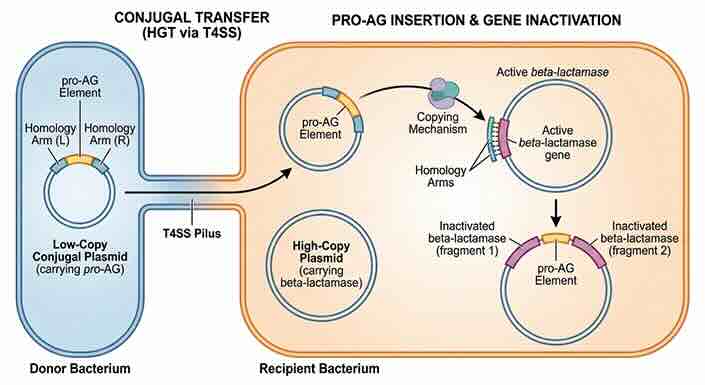
Conjugale (‘parings’-)overdracht van het genmateriaal aan andere bacteriën die ervoor zorgt dat die de resistentiegenen kwijt raken (afb: Ethan Bier et al./Nature Antimicrobials and Resistance)
Alweer een stukje over antibioticare-sistentie. Dat dreigt een groot probleem te worden. Weten-schappers van UC San Diego zouden nu een nieuwe CRISPR-techno-logie hebben ont-wikkeld die niet alleen resistente bacteriën bestrijdt, maar hun resis-tentie tegen geneesmiddelen ook actief kan verwijderen. Geïnspireerd door gendruk die bij de bestrijding van insecten wordt gebruikt, verspreidt de technologie een genetische ‘oplossing’ door bacteriële populaties, zelfs in hardnekkige biolagen die microben beschermen tegen antibiotica, zo luidt het verhaal.
Ziekteverwekkende bacteriën passen zich voortdurend aan en vinden nieuwe manieren om behandelingen te overleven die hen ooit uitroeiden. Als gevolg hiervan verspreiden zich steeds meer resistente bacteriën en prognoses suggereren dat ze tegen 2050 verantwoordelijk zouden kunnen zijn voor meer dan 10 miljoen sterfgevallen per jaar wereldwijd. Dat heeft alles te maken met het onverantwoorde gebruik van die middelen, onder meer ook in veehouderij.
Ethan Bier en Justin Meyer van de universiteit van Californië in San Diego zijn niet bij de pakken gaan neerzitten. Hun aanpak bouwt voort op CRISPR-genbewerking en leent concepten van gendruk, die bij insecten worden gebruikt om de verspreiding van schadelijke eigenschappen, zoals malariaparasieten, te blokkeren.
De onderzoekers ontwikkelden een tweede generatie systeem dat ze pPro-MobV noemden. Deze verbeterde technologie is ontworpen om zich te verspreiden door bacteriële gemeenschappen en de genen uit te schakelen die hen resistent maken tegen antibiotica. Bier: “Met pPro-MobV hebben we het denken over gendruk van insecten naar bacteriën gebracht als een instrument voor populatiemanipulatie. Met deze nieuwe CRISPR-technologie kunnen we een paar cellen nemen en die de vrije loop laten om antibioticaresistentie in een grote doelpopulatie te neutraliseren.”
De basis voor dit werk werd gelegd in 2019, toen het lab van Bier samenwerkte met de groep rond Victor Nizet aan de UCSD om het oorspronkelijke Pro-AG-systeem te ontwerpen. Die eerdere versie introduceerde een genetische gencassette in bacteriën, waardoor die zichzelf kon kopiëren in bacteriële genomen en genen voor antibioticaresistentie kon uitschakelen.
Deze cassette richt zich specifiek op resistentiegenen die zich bevinden op plasmiden, kleine cirkelvormige DNA-moleculen die zich vermenigvuldigen in bacteriecellen. Door zichzelf in deze plasmiden in te voegen, verstoort de cassette de resistentiegenen en maakt de bacterie weer vatbaar voor antibiotica.
Het nieuwere pPro-MobV-systeem bouwt voort op dit concept door middel van conjugale overdracht, een proces vergelijkbaar met paring, om CRISPR-componenten van de ene cel naar de andere te verplaatsen. De onderzoekers zouden hebben aangetoond dat het systeem zich kan verplaatsen via een natuurlijk ‘paringskanaal’ dat tussen bacteriën wordt gevormd, waardoor de resistentie-uitschakelende elementen zich over populaties verspreiden.
Deze methode werkt in biolagen. Dat zijn dichte gemeenschappen van micro-organismen die zich aan oppervlakken hechten en die notoir moeilijk te verwijderen zijn met standaardschoonmaakmethoden. Ze spelen een rol bij ernstige infecties en helpen bacteriën overleven bij een antibioticabehandeling door een beschermende barrière te vormen die de penetratie van geneesmiddelen beperkt. Daarom zou de nieuwe aanpak belangrijke toepassingen kunnen hebben in. onder meer, ziekenhuizen en milieusanering.
“Dat is bijzonder belangrijk voor de bestrijding van antibioticaresistentie, omdat dit een van de moeilijkste vormen van bacteriële groei is om te overwinnen in de kliniek of in afgesloten omgevingen zoals aquacultuurvijvers en rioolwaterzuiveringsinstallaties”, zegt Bier. “Als je de verspreiding van dieren naar mensen kunt verminderen, zou je een aanzienlijke effect kunnen hebben op het probleem van antibioticaresistentie, aangezien naar schatting ongeveer de helft ervan afkomstig is uit het milieu.”
Bacteriofagen
De onderzoekers ontdekten ook dat elementen van hun actieve genetische systeem kunnen worden getransporteerd door bacteriofagen, virussen die van nature bacteriën besmetten. Fagen worden al gemanipuleerd om antibioticaresistentie te bestrijden door de bacteriële afweer te omzeilen en verstorend genetisch materiaal in cellen te brengen. De onderzoekers verwachten dat pPro-MobV samenwerkt met deze gemanipuleerde fagen om het effect te versterken.
Als extra beveiliging kan het platform een proces bevatten dat bekend staat als homologische deletie, waardoor wetenschappers de ingevoegde genetische cassette indien nodig kunnen verwijderen. “Deze technologie is een van de weinige manieren die ik ken om de verspreiding van antibioticaresistente genen actief om te keren, in plaats van deze alleen maar te vertragen of te beheersen”, zegt Meyer, die zich bezighoudt met de evolutionaire aanpassingen van bacteriën en virussen.
Bron: Science Daily
