
Onderzoekers vervingen in het DNA van embryonale niercellen afzonderlijke basen (afb: Nature)
We hadden sinds een aantal jaren al de genschaar CRISPR/Cas9, maar er zijn nu ook twee molecuulscharen ontwikkeld die base voor base kunnen losknippen, waarmee deze techniek nog een stuk preciezer wordt (kan worden), niet alleen bij DNA, maar ook bij RNA. Een base (preciezer nucleobase) is de bouwsteen van het DNA, ook wel letters genoemd: A.C. G en T, voor RNA komt de U (uracil) in plaats van de T. De nieuwe baseschaar voor DNA is ontwikkeld door een groep van de Harvard-universiteit, de RNA-schaar door een groep van het Broad-instituut van MIT. Dat zou betekenen dat de CRISPR-schaartechniek nu te gebruiken zou zijn voor meer dan de helft van de genetische ziektes, maar pin me daar alsjeblieft niet op vast…
De nieuwe DNA-schaar is een aanpassing van het CRISPR-systeem. Er zijn eerder pogingen gedaan daarmee afzonderlijke basen aan te pakken, maar die waren niet heel succesvol (want nogal ‘slordig’). Die nieuwe technieken werken als een chemische scalpel, zegt David Liu van de Harvard-universiteit (mede) over zijn eigen werk.
Het vorig jaar meldde zijn groep een methode ontwikkeld te hebben die base voor base kan vervangen, zonder dat de dubbele DNA-helix gesplitst hoeft te worden. Sindsdien is die methode gebruikt om genen van schimmels, planten, vissen en muizen en zelfs menselijke embryo’s met een bloederziekte te veranderen. Die baseschaar kon echter alleen maar een C (cytosine) door een T (thymine) vervangen en een G (guanine) door een A (adenine).
De nieuwe baseschaar van het Harvard werkt de andere kant op: T vervangen door C en A door G. Daardoor zijn de meeste puntmutaties (mutaties waar slechts een enkele base in een gen is veranderd) te repareren.
In embryonale niercellen en botkankercellen leverde de techniek een rendement van 50% op, terwijl er vrijwel geen onbedoelde bijeffecten waren. Ter vergelijking: als je de foute base wil vervangen door met de ‘ouderwetse’ CRISPR-schaar een stuk DNA weg te knippen (dus niet alleen die ‘foute’ base) heeft een efficiëntie van 5% en levert heel wat ongewenste bijeffecten zoals het verdwijnen van hele stukken DNA.
RNA-knipper
De methode van het Broad-instituut, ontwikkeld onder aanvoering van Feng Zhang (veel Chinese namen in Amerikaanse instituten), doet iets soortgelijks maar dan bij RNA, het actieve broertje van DNA. De ‘schaar’ vervangt de A (adenine) door een I (inosine). De I wordt door de eiwitbouwmachine, het ribosoom, gelezen als een G (guanine).
Met deze RNA-therapie kan een ziekmakende mutatie tijdelijk gerepareerd worden zonder het genoom permanent te veranderen. Dat is een in potentie veiliger behnadelingsmethode al zal die van tijd tot tijd herhaald moeten worden. RNA-therapie geeft onderzoekers ook de mogelijkheid de behandeling te veranderen als ze meer te weten komen van een ziekte. Zhang: “Als je de RNA-therapie gebruikt kun je die bijwerken.”
Zijn RNA-bewerker is gebaseerd op een in de natuur voorkomend enzym dat atomen herschikt in A zodat er een I ontstaat. De onderzoekers koppelden het enzym aan een ‘manke’ versie van het CRISPR-systeem, Cas13 in plaats van Cas9 dat aan DNA bindt. Met behulp van een gids-RNA wordt de schaar naar het juiste stukje RNA gebracht. Het moleculaire ‘knipwerk’ was in 25 tot 35% van de gevallen succesvol zonder veel bijkomende, onbedoelde effecten.
RNA-omweg
In de vorig jaar ontwikkelde baseschaar koppelden Liu c.s. een natuurlijk enzym aan een onwerkzame Cas9-schaar. Daarmee was de C door een T te vervangen. Er is echter geen enzym gevonden dat het omgekeerde doet in DNA. Dus gebruikten de onderzoekers een enzym dat RNA kan bewerken, net zoals Zhang en de zijnen.
De onderzoekers volgden bacteriële cellen gedurende zeven generaties en knutselden wat aan eiwitten om een enzym te produceren dat DNA herkent en manipuleert. Dat enzym was in staat om van adenine (A) inosine (I) te maken. Vervolgens kreeg de ‘schaar’ het voor elkaar om cytosine in een ongewijzigde DNA-streng in te voegen. Het DNA-reparatiesysteem van de cel deed vervolgens de rest.
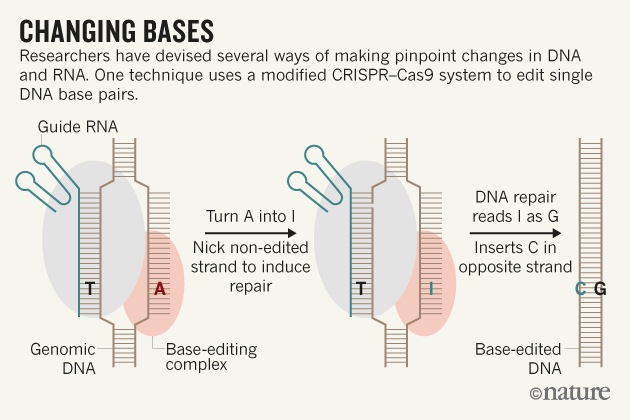
Het enzym veranderde de A in een I, dat door het DNA-reparatiesysteem wordt gelezen als een G, waartegenover het een C invoegt. Zo is via een omweg de T door een C vervangen. (afb: Nature)
“Dat is heroïsch werk”, zegt Dana Carroll van de universiteit van Utah, die niet aan het onderzoek heeft deelgenomen. “Ik zou niet de moed gehad hebben te doen wat zij gedaan hebben. Mijn petje af voor David Liu.” De mogelijkheid om de vier basen uit te wisselen (A naar G, G naar A, C naar T en T naar C) biedt grote mogelijkheden voor precisiereparaties aan genen. Andere basebewerkers (C vervangen door A, bijvoorbeeld) zouden enzymen moeten gebruikten die niet in de natuur voorkomen. Dat is voor Liu geen probleem: “We blijven doorgaan tot we alle basebewerkers hebben.
Bron: Nature
