DNA-afbraak met PLD3 (afb: Oliver Daumke et. al)
Een groep rond Oliver Daumke van het Max Delbrückcentrum vond een relatie met autoimmuunziektes en dementie bij een slechte afvalverwerking in de cel. Het eiwit PLD3 zou daar een belangrijke rol spelen.
Een groep rond Konstanze Winklhofer van de universiteit van Bochum vatte het eiwit NEMO bij de ‘hoorns’ en zag een relatie met Parkinson, waarbij, net zoals bij Alzheimer eiwitophopingen een kenmerkend verschijnsel is.
Net als bij ons thuis willen/moeten cellen van hun afval af, anders wordt het een smeerboel. Anders dan wij mensen gaan cellen heel wat netter om met hun afval. Als kernzuren (RNA en DNA) worden afgebroken dan worden de bouwstenen daarvan weer hergebruikt. In principe kan dat ook bij de afbraak van eiwitten.
Als die afbraak van de onbruikbare of schadelijke rommel in de cellen niet goed verloopt, dan kunnen er ziektes ontstaan zoals Alzheimer of autoimmuunziektes, waarbij het eigen afweersysteem zich tegen het eigen lijf richt zoals reuma of multipele sclerose (MS). Uit proeven met muisjes is gebleken dat als je de afbraak van kernzuren in een cel tegengaat autoimmuunziektes kunnen ontstaan.
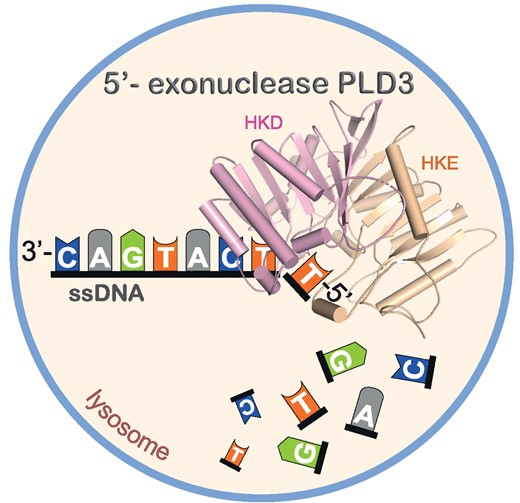
Hoe dat afbraakproces verloopt was nog niet goed onderzocht. “We weten wel hoe DNA en RNA worden gemaakt, maar het is veel minder onderzocht hoe de afbraak daarvan verloopt”, zegt Daumke. Dus ging hij met collega’s op onderzoek uit. Ze richtten hun aandacht op het eiwit PLD3 dat verantwoordelijk is voor de afbraak.
Eerst bestudeerden ze de structuur en konden de actieve delen ‘aanwijzen’ die betrokken zijn bij de afbraak van DNA en RNA. Daumke: “Zo konden we het afbraakproces en de ziekmakende mutaties in PLD3 beter begrijpen.”
PLD3
PLD3 behoort tot de familie fosfolipidases die in de afbraakorgaantjes in een cel, de lysosomen, vetten afbreken. Sedert enkele jaren worden mutaties in het PLD3-gen in verband gebracht met Alzheimer. “Het lijkt er op dat PLD3 in plaats van vetten DNA en RNA afbreekt”, zegt medeonderzoeker Markus Damme van de Christian-Albrechtsuniversiteit in Kiel.
Hoe dat proces verloopt was echter duister. Dus keken de onderzoekers wat beter naar het enzym om de relatie met Alzheimer te kunnen leggen. “We zagen dat twee van deze eiwitten een dimeer vormen”, zegt Yvette Roske uit de groep van Daumke. “Dat kennen we niet van de andere eiwitten uit die familie.” Het zou kunnen zijn dat die dimeervorming het enzym (=eiwit) stabieler maakt, speculeren de onderzoekersters.
Ook vonden ze twee plaatsen op het enzym die van belang voor de ziekte van Alzheimer zouden kunnen zijn. Zou dat dan de nog steeds niet gevonden oorzaak van Alzheimer kunnen zijn? Nu willen ze daar wat dieper induiken.
NEMO
NEMO, het onderzoeksobject in het tweede celafvalonderzoek, heet volgens GeneCards vooral IKBKG. Dat eiwit speelt een rol in de signaalprocessen voor het afweersysteem en zorgt voor het opruimen van eiwitophopingen zoals die bij de ziekte van Parkinson voorkomen (Lewislichaampjes van ⍺-synucleïne).
NEMO bindt zich aan eiwitketens die een merkteken vormen voor af te breken afval.
Dat merkteken dat verbindingen tot af te breken afval bestempelt bestaat uit een keten van ubiquitine-moleculen. Winklhofer: “Afhankelijk van de verbinding met die moleculen kunnen de afvalverwerkers in de cel aflezen hoe dat moet gebeuren.”
Uit ander onderzoek was al duidelijk geworden dat een zeldzame vorm van ubiquitines, de lineaire, bescherming biedt tegen de giftigheid van eiwitophopingen. Daarbij, zo blijkt nu, speelt NEMO een belangrijke rol. Dat eiwit bindt aan lineaire ubiquitines op de eiwitophopingen en stimuleert de afbraak van ⍺-synucleïne. Als NEMO geblokkeerd wordt dan vermindert de autofagie, het proces dat de afval verpakt en buiten de cel brengt.
De onderzoeksters ontdekten dat NEMO daarbij samenwerkt met het autofagie-eiwit p62. Dat vormt met NEMO en de (lineaire) ubiquitineketen een complex dat het mogelijk maakt de ophopingen af te breken.
Het bleek uit contact met collega’s in San Francisco dat een patiënte die al met 40 jaar Parkinson had gekregen een mutatie van NEMO had die het onmogelijk maakt dat dat eiwit zich bindt aan lineaire ubiquitines en dus ook niet aan de afbraak van de eiwitophopingen kan beginnen.
De patiënte had ophopingen van ⍺-synucleïne in de hersens, maar ook ophopingen die kenmerkend zijn voor Alzheimer (beta-amyloïde en tau-knopen). “Dat verklaart het verloop van de met NEMO verbonden ziekte en is een steun voor de algemene rol van NEMO bij de kwaliteitscontrole van eiwitophopingen (zoals wij die zien; as)”, zegt de onderzoekster. Nu Winklhofer en de haren dat mechanisme hebben opgehelderd zijn ze met onderzoek bezig om te kijken of die ontdekking iets kan betekenen in de bestrijding van de ziekte.
Bronnen: idw-online.de, idw-online.de
