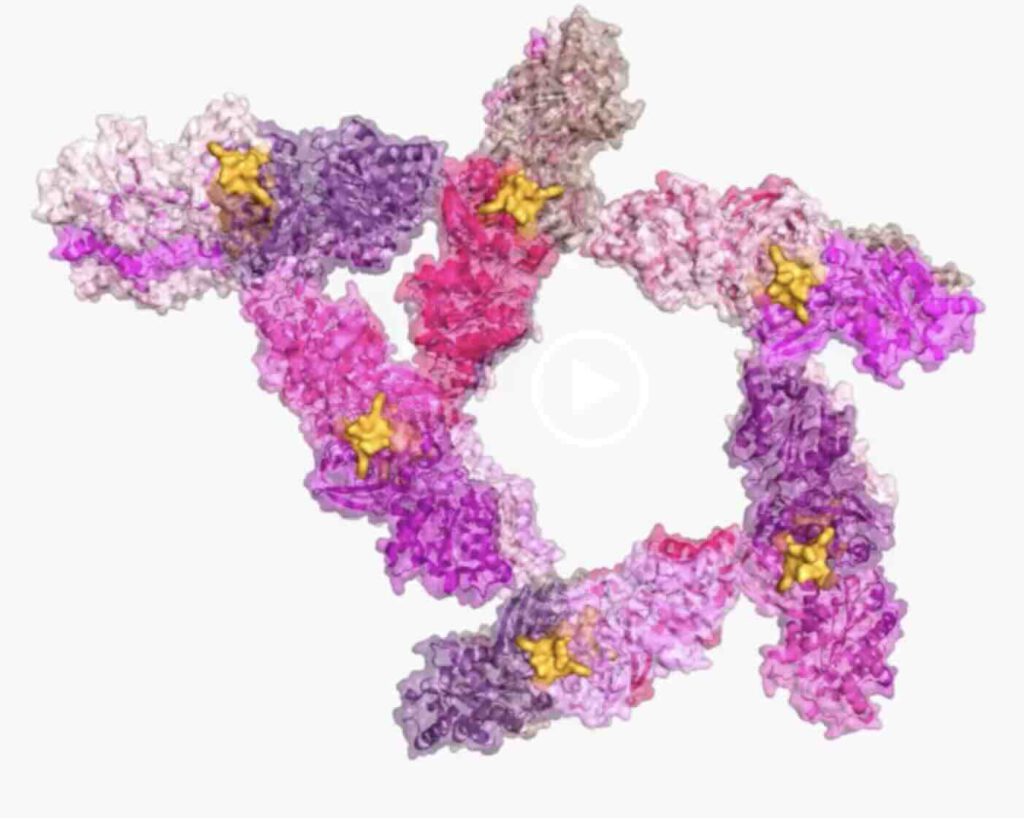
CARF-effectoren, hier Cat1 (denk ik=as), maken het bacteriofagen onmogelijk zich te vermenigvuldigen (afb: Rockefelleruniversiteit)
Elk levend organisme op aarde moet zichzelf beschermen tegen dingen die het kwaad kunnen doen. Bacteriën zijn daarop geen uitzondering en ondanks hun relatieve eenvoud, zetten ze opmerkelijk slimme verdedigingsstrategieën in tegen virale indringers. De bekendste is CRISPR/Cas9 die nu ook gebruikt wordt voor onderzoek, maar ook voor het ‘repareren’ van ziekmakende genetische afwijkingen. Er zijn nog andere bacteriële afweermechanismen tegen virussen en er is (dus) nog veel te ontdekken. Die zogeheten CARF-effectoren van bacteriën lijken me(=as) overigens vooral ‘wapens’ tegen virale infecties en hebben weinig met genoombewerking te maken.
Het afgelopen jaar hebben onderzoekers van het Laboratorium voor Bacteriologie van de Rockefelleruniversiteit, onder leiding van Luciano Marraffini, en van het Laboratorium voor Structurele Biologie van het Sloan-Ketterinkankercentrum, onder leiding van Dinshaw Patel, belangrijke afweerbestanddelen van enkele CRISPR-systemen bestudeerd, CARF-effectoren genaamd. Deze nieuw ontdekte wapens gebruiken verschillende benaderingen om hetzelfde doel te bereiken: het stoppen van cellulaire activiteit, wat voorkomt dat een virus zich verspreidt door de rest van de bacteriepopulatie.
De onderzoekers presenterende nu de laatstelijke ontdekte CARF-effector, die ze Cat1 hebben genoemd. Dankzij een ongewoon complexe molecuulstructuur kan dit eiwit een metaboliet uitputten die essentieel is voor celfuncties. Zonder brandstof komen de plannen van de virale indringer voor een verdere aanval abrupt tot stilstand. “Wij laten zien hoe effectief en verschillend deze CARF-effectoren zijn”, zegt Marraffini. “Het bereik van hun moleculaire activiteiten is echt verbazingwekkend.”
CRISPR is een mechanisme in het lerende afweersysteem van bacteriën en bepaalde andere eencellige organismen dat bescherming biedt tegen virussen, bacetriofagen (=bacterievreters) genaamd. De zes typen CRISPR-systemen werken ongeveer op dezelfde manier: een CRISPR-RNA identificeert een vreemde genetische code, die een Cas-enzym activeert om een afweerreactie te ontketenen, waarbij vaak het genetische indringermateriaal wordt verknipt en in eigen bacteriële DNA ingevoegd.
Er is echter steeds meer bewijs dat CRISPR-systemen een breed scala aan verdedigingsstrategieën inzetten die verder gaan dan ‘genchaar’mechanismen. Het laboratorium van Marraffini heeft het voortouw genomen in veel van dit onderzoek. Ze hebben met name een klasse moleculen in CRISPR/Cas10-systemen bestudeerd, genaamd CARF-effectoren. Dit zijn eiwitten die worden geactiveerd na besmetting van een bacterie door fagen.
Aangenomen wordt dat de afweer van CARF-effectoren werkt doordat die een onherbergzame omgeving creëren voor virale replicatie. Zo veroorzaakt de Cam1-CARF-effector membraandepolarisatie van een geïnfecteerde cel, terwijl Cad1 een soort moleculaire ‘uitroking’ in gang zet, waardoor een besmette cel wordt overspoeld met giftige moleculen.
Vergiftiging
Voor de huidige studie wilden de onderzoekers proberen extra CARF-effectoren te identificeren. Ze gebruikten Foldseek, een krachtige zoekmiddel voor structurele homologie, om Cat1 te vinden. Ze ontdekten dat Cat1 wordt gewaarschuwd voor de aanwezigheid van een virus door de binding van secundaire boodschappermoleculen (cyclisch tetra-adenylaat of in afko cA4) die het enzym stimuleren om een essentiële metaboliet in de cel, NAD+, af te breken.
“Zodra voldoende >NAD+ is afgebroken stopt de cel met groeien”, zegt medeonderzoeker en promovendus Christian Baca. “Met die cefunctie op pauze kan de faag zich niet meer voortplanten en verspreiden naar de rest van de bacteriële populatie. In dit opzicht is Cat1 vergelijkbaar met Cam1 en Cad1, omdat ze allemaal bacteriële immuniteit op populatieniveau bieden.”
Hoewel de immuunstrategie van het eiwit mogelijk vergelijkbaar is met die van deze andere CARF-effectoren, is de vorm dat niet, zoals medeonderzoekster Puja Majumder ontdekte na gedetailleerde structuuranalyse met een diepgekoelde elektronenmmikroskoop.
Ze ontdekte dat het Cat1-eiwit een verrassend complexe structuur heeft, waarbij Cat1-dimeren aan elkaar worden geplakt door het cA4-signaalmolecuul, waardoor lange vezels ontstaan na een virale infectie en de >NAD+-metabolieten worden opgesloten in kleverige moleculaire holtes. “Zodra de >NAD+-metaboliet is gekliefd door Cat1-filamenten, is die niet meer beschikbaar voor de cel”, zegt Majumder. “De vezels wisselwerken met elkaar om driehoekige spiraalbundels te vormen. Deze bundels kunnen zich vervolgens uitbreiden tot vijfhoekige spiraalbundels.” Wat de functie van die spiraalbundels is moet nog worden onderzocht.
Ook ongebruikelijk is dat Cat1 vaak alleen lijkt te werken. Baca: “Normaal gesproken zijn er in type III-CRISPR-systemen twee activiteiten die bijdragen aan het afweereffect. De meeste bacteriën die Cat1 coderen, lijken echter voornamelijk op Cat1 te vertrouwen voor hun afweer.”
Gelukkig voor de onderzoekers levert dit onderzoek intrigerende nieuwe vragen op. Marraffini: “Hoewel ik denk dat we het grote plaatje hebben bewezen – dat CARF-effectoren uitstekend zijn in het voorkomen van faagreplicatie – moeten we nog veel leren over de details van hoe ze dat doen. Het is fascinerend om te zien waar dit werk ons nu naartoe leidt.”
Bron: Science Daily
