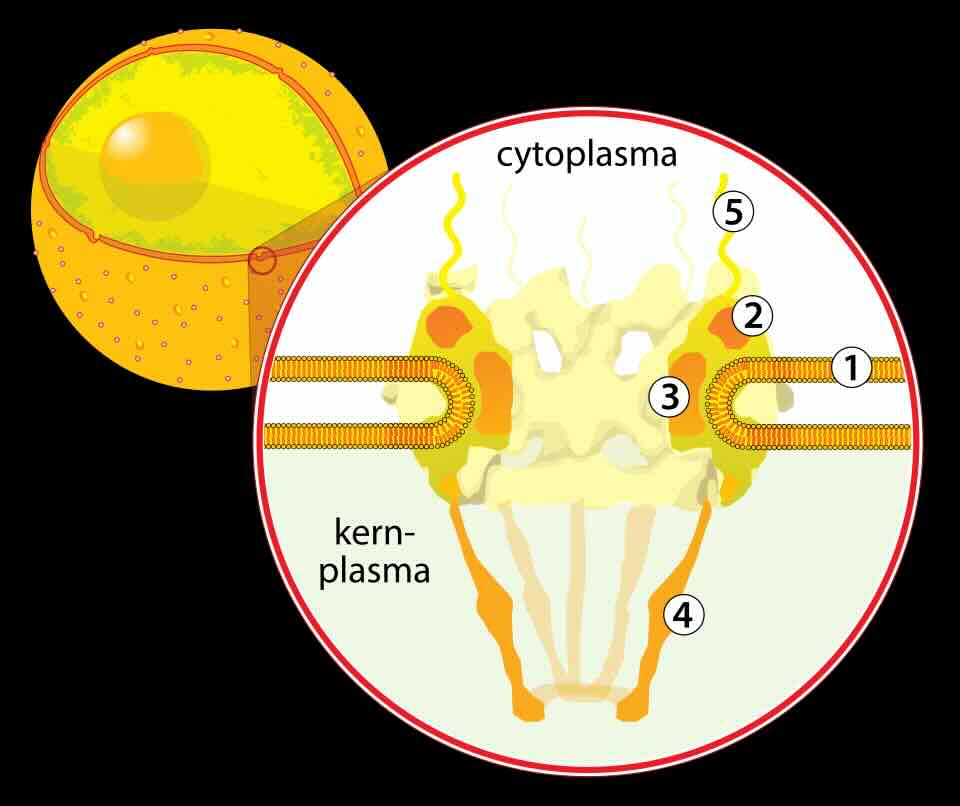
Porie in membraan rond celkern: 1) kernmembraan, (2) ringstructuur die de basis vormt van de porie, (3) tussenspaken, (4) korf en
(5) de cytoplasmadraden (afb: WikiMedia Commons)
Gentherapie biedt de mogelijkheid om ziekten te voorkomen of te genezen door de genexpressie (genactiviteit) in de cellen van een patiënt te manipuleren. Om effectief te zijn, moet het nieuwe, toe te voegen gen echter wel in de celkern terechtkomen. Dat gebeurt met de huidige methodes maar mondjesmaat. Onderzoekers van de universiteit van Californië San Diego rond Neal Devaraj hebben een nieuwe methode ontwikkeld die de effectiviteit van genafgifte aanzienlijk zou verhogen en tegelijkertijd schadelijke bijwerkingen voor de cel zou verminderen.
Om gentherapie effectief te laten zijn, moet het geïntroduceerde gen de doelcellen bereiken en uiteindelijk van het cytoplasma (celvloeistof) naar de celkern worden getransporteerd. Hoewel genafgifte in het cytoplasma een bekende en gestandaardiseerde methode is, kan het transporteren van genen vanuit het cytoplasma naar de celkern behoorlijk lastig zijn (ook de celkern is door een beschermend membraan omringd).
Om die lage efficiëntie (geschat op rond 1%) te compenseren, moeten bij gentherapieën vaak zeer hoge doses genmateriaal worden aangevoerd om ervoor te zorgen dat dat genmateriaal in voldoende de celkernen terechtkomt. Die hoge doses kunnen ongewenste afweerreacties en celvergiftiging veroorzaken.
Afgifte van genmateriaal in de celkern kan worden gedaan met behulp van nucleaire lokalisatiesignalen (NLS). Dat zijn korte peptiden die fungeren als moleculaire postcodes door bepaalde eiwitten te ‘merken’ voor transport naar de celkern. Door het genmateriaal aan het NLS te koppelen, kan het meeliften naar de celkern. Hoewel deze methode al tientallen jaren in ontwikkeling is, zijn de resultaten tot nu toe niet om over naar huis te schrijven.
Het grootste probleem van deze methodologie was dat de biochemie tot nu toe onvoldoende ontwikkeld was om wetenschappers in staat te stellen echt te zien (en dus te begrijpen?) wat er gebeurt tijdens de nucleaire DNA-NLS-afgifte. Is de lengte van het NLS van belang? Is de afstand tussen het NLS en het DNA van belang? Gebruiken onderzoekers de verkeerde NLS-sequenties? Moeten ze verschillende NLS’en aan het DNA koppelen?
Er was behoefte aan een manier om gemakkelijk te bepalen welke combinaties de beste resultaten opleveren. Dit zou Devaraj en de zijnen voor elkaar hebben gekregen met chemisch werkschema waarmee DNA-NLS-complexen eenvoudig kunnen worden ‘doorgelicht’ en gebruikers de parameters van de complexen kunnen definiëren.
“Met dit schema konden we in feite de ontwerpregels definiëren waarmee je een van deze NLS-peptiden aan een DNA-gencassette kunt koppelen. We zagen een meer dan vertienvoudiging in de aflevering van genmateriaal in de kern”, zegt medeonderzoeker Zulfiqar Mohamedshah.
Het nieuwe werkschema is gebaseerd op een enzymatische DNA-merktechnologie, DNA-TAG, die eerder in het Devaraj-lab is ontwikkeld. In dit onderzoek gebruikten de onderzoekers een bacterieel enzym, TGT (tRNA-guanine-transglycosylase), om DNA te modificeren met een chemische basis die de daaropvolgende, eenvoudige aanhechting van peptiden, waaronder NLS-peptiden, aan het genmateriaal mogelijk maakt.
Zo konden de onderzoekers stukjes DNA ‘opzadelen’ met NLS-peptiden en vervolgens de parameters van de NLS aanpassen (het type NLS, de afstand tussen de NLS en het genmateriaal en het aantal aan het DNA gehechte NLS-peptiden). De gencassette was gecodeerd met een eGFP-signaaleiwit dat groen oplicht in menselijke cellen na aflevering in de celkern en daar tot tot expressie komt (actief wordt).
Op deze manier konden ze verschillende combinaties van DNA-NLS-verbindingen ‘doorlichten’ om te zien welke combinaties het meest effectief waren in het binnendringen van de celkern. Deze nieuwe werkmethode stelt onderzoekers in staat om de DNA-NLS-complexen met de hoogste kernafgifte te achterhalen en in te zetten. Door het hoger succes van de celkerntoegang hoefde er minder genmateriaal worden gebruikt. Dat zou de problemen met celvergiftiging moeten verminderen, stelt Deveraj.
Proef
Om hun werkwijze te testen, dienden de onderzoekers een gen toe dat codeert voor stollingsfactor IX (een eiwit dat ontbreekt bij de hemofilie B, ook wel ziekte van kerstmis genoemd). Hun resultaten toonden een tienvoudig hogere expressie van Factor IX dan bij de controlegroep, wat het potentieel van DNA-NLS-complexen voor gentherapietoepassingen aangeeft waarbij geen virussen als gentransportmiddel worden gebruikt.
Het onderzoek zou ook hebben uitgewezen dat specifieke DNA-NLS-sequenties beter werken in bepaalde weefseltypen. Zo is leverweefsel voor specifieke NLS-peptiden beter geschikt voor kernbinnendringing dan voor hart- of nierweefsel. Verder onderzoek zou kunnen uitwijzen hoe deze DNA-NLS-complexen precies kunnen worden ingezet.
De onderzoekers willen verder uitzoeken of het toedienen van DNA-NLS-complexen aan de cel de afweerreactie vermindert, een andere probleem bij dit soort gentherapieën. Ze onderzoeken ook de toepassing van het werkschema op het stimuleren van DNA-bewerkingen met behulp van CRISPR/Cas9 en hopen dat verder te verfijnen tot iets dat klinisch beter toepasbaar en opschaalbaar is en daarmee dichter bij de patiënt brengt.
Bron: phys.org
