CRISPR-remmers geven meer ‘houvast’ bij genoombewerking (afb: Katherina Wandera et al./Molecular Cell)
De CRISPR/Cas-genschaar biedt een breed scala aan potentiële toepassingen, van de behandeling van genetische ziekten tot antivirale therapieën en diagnostiek. Om hun krachten echter veilig te benutten, zoeken wetenschappers nog steeds naar mechanismen die de activiteit van die systemen kunnen sturen. Het anti-CRISPR-eiwit AcrVIB1 is een veelbelovende remmer waarvan de exacte functie tot nu toe duister. Onderzoekersters van, onder meer, het Helmholtzinstituut voor RNA-besmetting HIRI in Würzburg hebben ontdekt hoe AcrVIB1 werkt (pdf-bestand), wat de mogelijkheden waarmee Acr’s CRISPR kunnen uitschakelen zijn toegenomen. Er liggen waarschijnlijk nog meer mogelijkheden braak.
Bacteriën en hun virussen, bekend als (bacterio)fagen, zijn verwikkeld in een aloude wapenwedloop. Om zich te verdedigen tegen fagen, hebben bacteriën geavanceerde mechanismen ontwikkeld om binnendringende virussen te herkennen en te lijf te gaan.
Op hun beurt hebben fagen nieuwe strategieën ontwikkeld om deze afweer te ontwijken. Een goed voorbeeld van deze voortdurende strijd is het CRISPR/Cas-verdedigingssysteem in bacteriën, tegengegaan door anti-CRISPR-eiwitten (Acr’s) in fagen, die specifiek deze bacteriële ‘genscharen’ blokkeren.
Afgezien van hun tegenafweerfunctie, zijn anti-CRISPR-eiwitten veelbelovend voor het mogelijk maken van een nauwkeuriger sturing van CRISPR-technieken. Om daar gebruik van te kunnen maken is het uiteraard essentieel om te begrijpen hoe die werkt. HIRI-onderzoekersters hebben in samenwerking met de Julius-Maximilians-universiteit Würzburg (JMU) en wetenschappersters van het Helmholtzinstituut voor bemsettelijke ziektes HZI nu de functie van een belangrijk anti-CRISPR-eiwit ontraadseld.
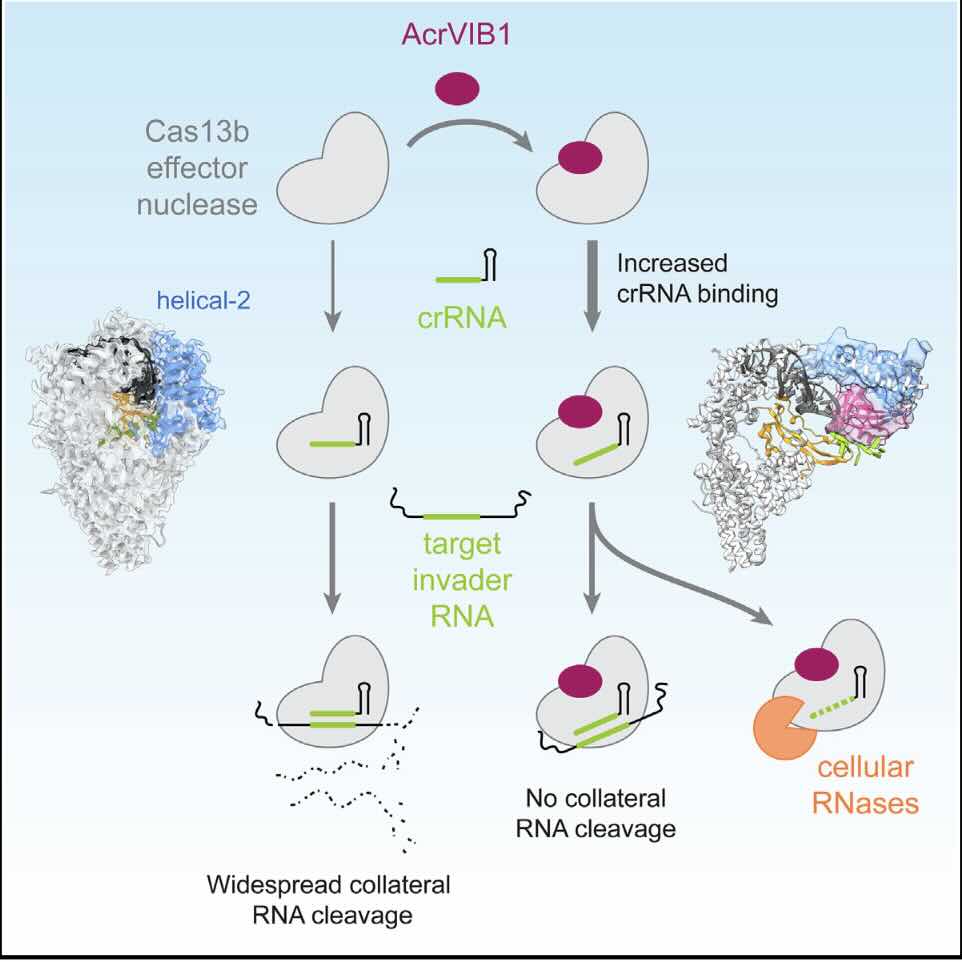
“In een eerdere studie gebruikten we een ki-algoritme om nieuwe Acr’s te voorspellen. Dit leidde tot de ontdekking van AcrVIB1, het eerste anti-CRISPR-eiwit gericht op de Cas13b-nuclease,” zegt Chase Beisel van HIRI, die de studie leidde. “De nuclease Cas13b kan RNA herkennen en knippen. Dat enzym wordt momenteel gebruikt om genen tot zwijgen te brengen, om hun functie te bestuderen, virussen te verwijderen of genetische ziekten tegen te gaan die aan een gen zijn gekoppeld.” Hoe het eiwit AcrVIB1 Cas13b remt, was echter tot nu toe duister.
Een RNA-doodlopende weg
De Cas13b-nuclease werkt door interactie met een CRISPR-ribonucleïnezuur (crRNA), dat dient als een gidsmolecuul om overeenkomstige RNA-sequenties te identificeren en zich eraan te hechten, bijvoorbeeld bij fagen. Zodra het doel-RNA gebonden is, kan Cas13b niet alleen deze complementaire RNA-moleculen afbreken, maar ook alle andere RNA’s in de buurt.
Terwijl de meeste bekende anti-CRISPR-eiwitten stappen op dit pad blokkeren, zoals crRNA-binding of doelherkenning, hanteert AcrVIB1 een radicaal andere strategie. In plaats van de binding van het crRNA met Cas13b te blokkeren, verbetert AcrVIB1 deze juist. Het gevormde paar is echter niet functioneel, wat betekent dat het enzym niet kan beginnen met het afbreken van RNA’s, zelfs niet als het doel aanwezig is. Bovendien wordt het gebonden crRNA kwetsbaar voor aanvallen door ribonucleasen in de cel, die RNA-moleculen afbreken.
“De strakkere binding tussen nuclease en gids-RNA was volkomen onverwacht. Het eenvoudigere en daarom ook verwachte mechanisme zou zijn geweest om te voorkomen dat het gids-RNA zich zou binden”, zegt hoofdauteur Katharina Wandera, die promoveerde in het laboratorium van Beisel. “Toch lijkt het pad dat AcrVIB1 bewandelt effectiever. AcrVIB1 bindt zich stevig aan Cas13b en maakt het eiwit daardoor inactief. Tegelijkertijd verhoogt het de afbraak van gids-RNA’s, waardoor Cas13b een doodlopende weg wordt voor crRNA’s.”
De onderzoekersters hebben met behulp van cryo-elektronenmicroscopie waargenomen dat AcrVIB1 zich bindt aan Cas13b, waardoor het crRNA-bindende domein niet meer werkt. “Onze bevinding biedt een blauwdruk voor de ontwikkeling van moleculen die de functie van het anti-CRISPR-eiwit kunnen nabootsen of wijzigen,” zegt Wulf Blankenfeldt van HZI.
Toekomst
“In de toekomst zouden we moleculen zoals AcrVIB1 kunnen gebruiken om CRISPR-systemen te reguleren of tijdelijk te deactiveren in verschillende toepassingen”,stelt hij. Deze ontdekking biedt potentieel om de veiligheid en precisie van CRISPR-gebaseerde technologieën verder te verbeteren.
Wandera: “Het ontcijferen van dit mechanisme biedt ook waardevolle inzichten in de co-evolutie van bacteriën en virussen, die elkaar voortdurend proberen te slim af te zijn.” Het diepere begrip van bacteriële resistentie zou een cruciale rol kunnen spelen in de ontwikkeling van nieuwe antibiotica en de mogelijkheden van synthetische biologie kunnen uitbreiden.
Volgens Beisel is dit nog maar het begin van een uitbreiding van het CRISPR-‘gereedschap’. “Er zijn zeker nog veel meer Acr’s en andere stuurmechanismen die wachten om ontdekt te worden”
Bron: idw-online.de
