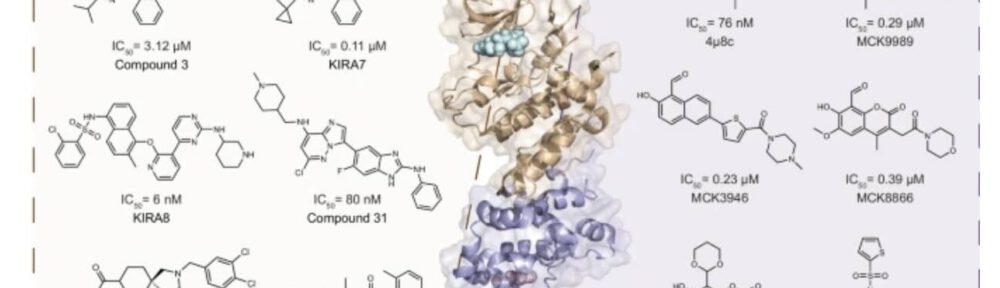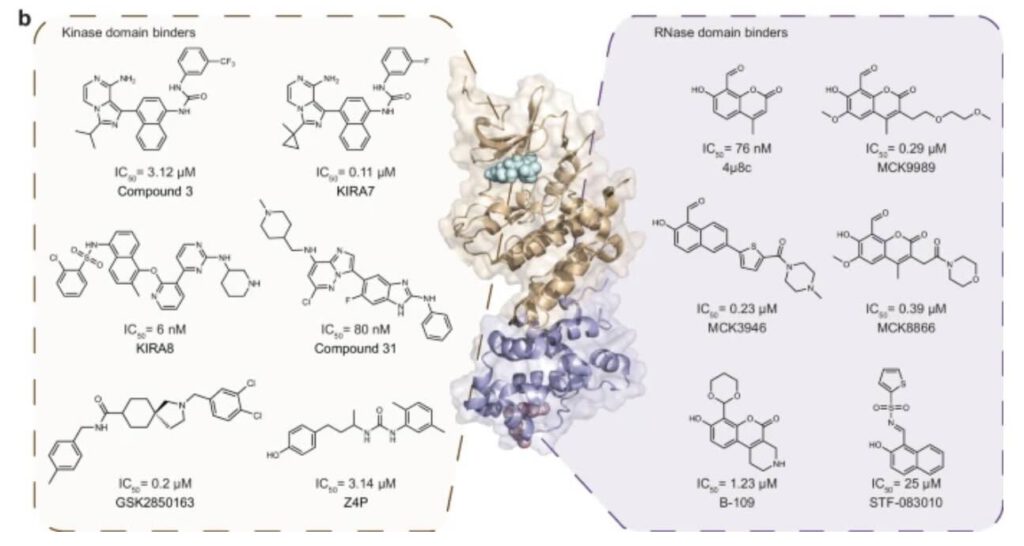
Voorbeelden van IRE1-remmers op de kinase-bindplaats of het RNAse-domein (afb: Peng Wu et al./Nature Communications)
Kankercellen lijken behoorlijk ‘slim’ te zijn. Ze kapen overlevings- en genezingsprocessen van cellen om hun groei te stimuleren, zich door het lichaam te verspreiden en hun eigen overleving te garanderen. De ontvouwde eiwitrespons, die cellen beschermt tegen stress, is zo’n overlevingsmechanisme. Een van de belangrijkste regulatoren, het inositol-afhankelijke enzym 1 (IRE1), is een veelbelovend doelwit gebleken voor de ontwikkeling van therapieën tegen kanker en diverse andere ernstige ziekten. Nu hebben onderzoekers rond Peng Wu van het Max Planck Instituut voor Moleculaire Fysiologie in Dortmund hebben een middel ontwikkeld dat IRE1 remt via een ander mechanisme dan bestaande remmers. Dit zou nieuwe therapeutische mogelijkheden kunnen openen voor de behandeling van kanker en andere ziekten. Cellen kennen stress. Wanneer er te veel fout gaat in een cel dan schieten ze in een stress. Om daarmee om te gaan is er de zogeheten ontvouwde eiwitrespons (OER). Als die respons wordt geactiveerd door stress in een celonderdeel, het endoplasmatisch reticulum (ER) waar eiwitten worden geproduceerd, komt er een reeks aan reacties op gang om ervoor te zorgen dat de gevormde eiwitten op de juiste manier vouwen.
Een van de belangrijkste actoren in die respons is het eiwit IRE1 dat is ingebed in het membraan rond dat organel. Het eiwit is betrokken bij een breed scala aan ziekten, waaronder afweer-, stofwisselings- en neurodegeneratieve aandoeningen evenals kanker en is daardoor een relevant therapeutisch doelwit geworden.
Tumoren worden vaak omschreven als ‘wonden die nooit genezen’. Dit komt mede doordat kankercellen een giftige omgeving creëren, die zuur, zuurstof- en voedselarm is. Hoewel dit contraproductief lijkt, is het in feite een ‘slimme’ strategie. Die voor andere cellen vijandige omstandigheden activeren evolutionaire overlevingsmechanismen, die worden gekaapt en hergebruikt om tumorgroei en overleving te ondersteunen.
“Het is algemeen bekend dat de activering van de OER via IRE1 bijdraagt aan de ontwikkeling en progressie van de meeste vormen van kanker, zoals leukemie, glioblastoom, myeloom, borst- en darmkanker”, zegt Wu. “Hoge IRE1-activiteit wordt ook geassocieerd met een steeds slechtere vooruitzichten.”
Aantrekkelijke doelwitten
In het afgelopen decennium zijn de signaaleiwitten van de OER aantrekkelijke doelwitten geworden voor de ontwikkeling van nieuwe kankertherapieën. Er is nu een groeiende ‘kistje’ met medicijnachtige moleculen beschikbaar. Veel van deze verbindingen hebben echter beperkingen en veroorzaken soms aanzienlijke bijwerkingen, met name pancreastoxiciteit.
Het vermoeden bestaat dat bepaalde reactieve groepen in deze verbindingen interfereren met cellulaire processen die geen verband houden met de activiteit van IRE1. Bovendien worden sommige remmende mechanismen nog niet volledig begrepen.
De groep van Wu heeft nu een krachtige IRE1-remmer ontwikkeld met een bijzondere werkwijze. De onderzoekers gebruikten een robuuste test om het effect van potentiële IRE1-remmers te evalueren. Met behulp van deze reeks lichten ze een bibliotheek van 10 000 verbindingen en vonden zo bijzonder veelbelovende ’treffers’.
Deze aanpak leverde uiteindelijk een verbinding op die vervolgens biochemisch, biofysisch en door de interactie met IRE1 werd gekarakteriseerd. In plaats van één van de twee katalytische plaatsen (de kinase of het RNAse-domein) te remmen door eraan te binden, bindt de nieuw ontwikkelde remmer zich aan de kinase-bindplaats en onderdrukt daarmee de RNAse-activiteit die de OER aanstuurt.
Dergelijke verbindingen zouden ook kunnen dienen als onderzoeksinstrument om te bepalen welke aanpak voor kankerbestrijding het meest geschikt is in de klinische praktijk en welke ziekten bij mensen het meest effectief behandeld kunnen worden door zich te richten op de ontvouwde eiwitrespons.
Bron: phys.org