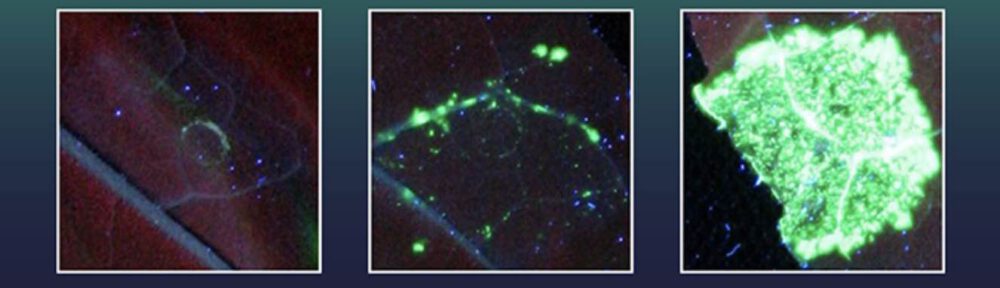
Inbouw van grote stukken DNA (gen X) in een tabaksplant. Van links naar rechts het resultaat met een inactieve Cas9-variant, een actieve DNA-variant en een combinatie met endonuclease (afb: Leibnizintituut IPB)
Wetenschappers rond Alain Tissier van het Leibnizinstituut voor plantenbiochemie (IPB) zijn er naar het schijnt voor het eerst in geslaagd grote gensecties op een stabiele en nauwkeurige manier zeer efficiënt in het DNA van planten in te voegen. Daartoe veranderden ze de CRISPR/Cas-methode voor het bewerken van genen. Het verbeterde proces biedt volgens de onderzoekers grote kansen voor gerichte genoombewerking van hogere planten voor zowel veredeling als wetenschap.
Genscharen zijn ideaal voor het uitschakelen van genen, dat wil zeggen het uitschakelen of verwijderen van bestaande genen, maar niet voor het nauwkeurig inbrengen van genen of het uitwisselen van stukken DNA. De genschaar is tot nu toe te inefficiënt gebleken voor invoegen van stukken DNA van hogere planten, stelt het IPB-persbericht.
“Dat ligt aan het eigen reparatiemechianisme voor DNA-breuken”, zegt medeonderzoeker Tom Schreiber. Deze reparatie-enzymen zijn er direct bij zodra er schade aan het DNA ontstaat. Ze herkennen ook de gladde sneden van de genschaar en brengen onmiddellijk de twee afgesneden DNA-strengen van de dubbele helix weer bij elkaar. Het repareren van het geknipte DNA gebeurt zeer snel en niet erg nauwkeurig.
“Deze onnauwkeurigheden zijn niet erg en voor mij zelfs wenselijk”, zegt Schreiber, “omdat ik het gen toch wil uitschakelen, maar als ik een gen wil invoegen, moet dat heel precies gebeuren. De genetische informatie moet nauwkeurig worden gebruikt, geen enkele bouwsteen mag ontbreken, anders verliest het gen zijn functie en is het hele experiment voor niets geweest.”
Daardoor is een dergelijke nauwkeurige en ‘littekenvrije’ invoeging van grotere genen of DNA-secties met behulp van CRISPR/Cas tot nu toe slechts zelden succesvol geweest. Om dat te verbeteren hebben de onderzoekers een ander enzym aan de genschaar toegevoegd, een zogeheten exonuclease.
Exonucleasen kunnen de door de genschaar geknipte DNA-snedes zo veranderen dat de reparatie-enzymen van de cel de DNA-schade niet meer kunnen herkennen en deze dus niet meer aan elkaar kunnen lijmen. Het met CRISPR/Cas in te bouwen DNA-fragment zou daardoor voldoende tijd hebben om met behulp van een ander, nauwkeurig celreparatiemechanisme op de juiste plek in het genoom te worden ingevoegd.
De onderzoekers beproefden verschillende exonucleasen van virale, bacteriële, plantaardige en menselijke oorsprong op hun vermogen om het aantal precieze geninvoegingen te verhogen. Met behulp van de genschaar moesten die exonucleasen er voor zorgen dat stukken DNA (gen X) met een lengte van duizenden nucleotiden (de bouwstenen van het DNA) in de bladcellen van de tabaksplant Nicotiana benthamiana werden ingebouwd.
De onderzoekers hadden deze tabakscellen eerder uitgerust met een gen voor een groen fluorescerende kleurstof dat geactiveerd wordt als het juiste gen X is ingevoegd. Twee van de geteste exonucleasen, waaronder één uit de herpesvirusfamilie, bleken bijzonder effectief.
Zandraket
Deze experimentele aanpak werd met andere stukken DNA en andere planten, zandraket en tarwe, getest. Omdat de DNA-invoeging bij tabaksplanten alleen in de bladeren plaatsvond, ging het toegevoegde X-gen bij de volgende generatie weer verloren.
Bij zandraket en tarwe moest het toegevoegde gen ook het kiembaangenoom worden opgenomen om doorgegeven te worden aan de volgende generaties. Dat lukte, maar slechts op bescheiden schaal. Zo had bij tarwe de volgende generatie slechts 1% van de dochterplanten het toegevoegde DNA-materiaal.
Schreiber: “Eén procent lijkt weinig, maar als een veredelaar een bepaalde eigenschap in zijn plant wil brengen, hoeft hij ons geoptimaliseerde CRISPR/Cas-proces alleen maar te gebruiken om zo’n 50 tot 100 planten te produceren. Dochterplanten van de eerste generatie gaan op zoek naar een plant met de gewenste eigenschap. Dit zou een aanzienlijke tijdsbesparing opleveren ten opzichte van conventionele veredelingsmethoden, waarbij je hiervoor 500 tot 1000 planten zou moeten analyseren.”
In de toekomst zouden plantenveredelaars dit proces kunnen gebruiken om verloren resistentiegenen tegen ziekteverwekkers van wilde soorten of oude gecultiveerde variëteiten te herintroduceren in moderne, hoogproductieve variëteiten. Voor de wetenschap biedt deze aanpak grote mogelijkheden om in één stap op elegante wijze bepaalde plantengenen te vervangen door gemodificeerde kopieën van zichzelf, stellen de onderzoekers. Dit is vooral nuttig bij het ophelderen van de functie van die genen.
Bron: idw-online.nl