Fouten bij het splitsen van bRNA kunnen leiden tot de celdood (afb: Ivan Đikić et al./Science)
Mensen hebben zo’n 20 000 genen, maar toch zijn cellen in staat op honderdduizenden verschillende eiwitten te produceren. Die verscheidenheid wordt mogelijk gemaakt door nabewerking van boodschapper-RNA’s die de ‘mal’ vormen voor die verscheidenheid.
Dat splitsproces wordt door verschillende eiwitten uitgevoerd dat in het Engels tezamen het spliceosome wordt genoemd, maar dat ik in dit blog splitsoom noem. Daarbij kan wel eens iets fout gaan en dan loopt de benodigde eiwitproductie in de soep en sterft de cel. Wellicht een doel voor een kanker- of Alzheimertherapie, denken de onderzoekers.
“Het splitsoom bestaat uit verschillende eiwitten die zorgen voor de aanmaak van functionele eiwitten die het celleven sturen”, zegt Ivan Đikić van de Goetheuniversiteit in Frankfurt. “Als dat complex kapot is dan kan dat tot de dood van de cel leiden. Daarom zijn splitsoomremmers waarschijnlijk ook potentiële kankergeneesmiddelen.” Dat kan wel, maar om dat hele bewerkingssysteem uit te schakelen tref je ook gezonde cellen en dat kan alleen maar problemen opleveren zoals in proeven met die middelen is geconstateerd.
De onderzoekers rond de Kroatische moleculair-bioloog denken nu een wat subtielere aanpak gevonden te hebben om het splitsproces te beïnvloeden. Dat gaat om drie subeenheden van het splitsoom: U4, U6 en U5. “We wisten al dat bepaalde mutaties in die subeenheden iets van doen hadden met de oogziekte retinitis pigmentosa (een verzamelnaam voor ziektes die het netvlies aantasten;as)”, zegt hoofdauteur Cristian Prieto-Garcia. “Wat we niet wisten wat het precieze effect was van die mutaties.”
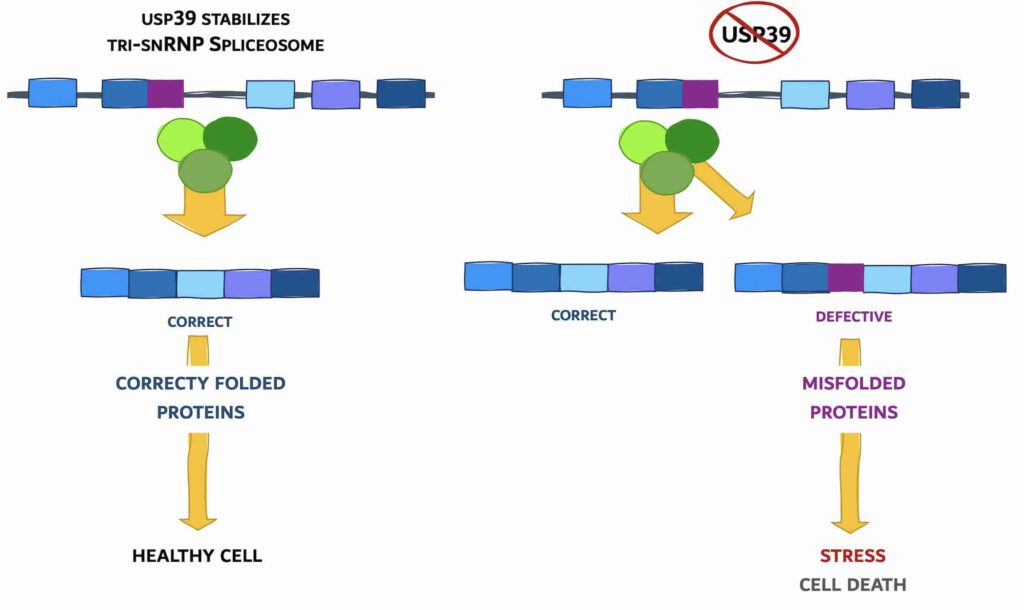
Daartoe deden de onderzoekers proeven met zebravisjes. Daaruit bleek dat U4, U5 en U6 zorgen voor een snelle en juiste verbinding van losse eindjes die bij het splitsen van het bRNA ontstaan. Die drie subeenheden worden normaal als complex gestabiliseerd door het eiwit USP39. Als die drie subeenheden gemuteerd zijn of als USP39 afwezig is dan gaat het mis en wordt de verbinding van de losse eindjes vertraagd.
Vertraging
Prieto-Garcia: “Die vertraging vergroot de kans op verkeerde verbindingen, zo bleek uit simulaties.” Dat leidt weer tot bRNA’s die coderen voor een niet (goed) functionerend eiwit. Die hopen op in de cel. Cellen hebben een opruimdienst en die zou geactiveerd worden als er geen USP39 in de cel aanwezig is. Uiteindelijk kan die productie van onfunctionele eiwitten de opruimdienst echter te machtig worden en dan volgt de celdood.
Đikić: We denken dat dat ook de verklaring is hoe het komt dat bij retinitis pigmentosa netvliescellen sterven. Foute splitsvarianten zouden ook een rol kunnen spelen in de ontwikkeling van hersenziektes als Alzheimer of Parkinson. Dat mechanisme zou een doel van behandelmethodes kunnen zijn voor bepaalde typen kanker die erg afhankelijk zijn van een goed functionerend splitsoom.”
Sommige erg agressieve kankers produceren USP39 en andere splitsfactoren in grote hoeveelheden, waarschijnlijk vanwege de hoge deelsnelheid van kankercellen. Daarvoor hebben ze een constante eiwitproductie nodig die afhankelijk is van de voor de kankercel juiste splitsing. Daar is USP39 goed voor. Đikić: “USP39 blokkeren bij deze kankers zou een middel zijn om die kankercellen te doden. Daar zouden gezonde cellen, die veel minder snel delen, weinig last van hebben. Dat traject bestuderen we nu.”
Bron: Alpha Galileo
