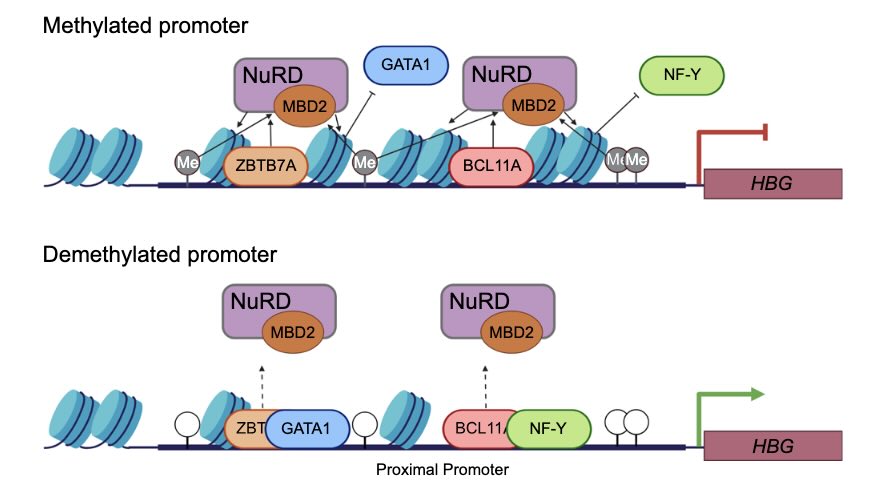
De promotor is een deel van een gen dat in gemethyleerde vorm het gen inactief maakt (en viceversa) (afb: Merlin Crossley et al./Nature Comunications)
Jarenlang hebben onderzoekers zich afgevraagd of methylgroepen, die chemische deactivering, alleen verschijnen waar genen al zijn uitgeschakeld, of dat ze de directe oorzaak zijn van genonderdrukking.
In een recent gepubliceerde studie hebben de onderzoekers van de UNSW aangetoond dat het verwijderen van deze chemische ‘vlaggen’ ervoor zorgt dat genen weer actief worden. Wanneer die weer worden toegevoegd, worden de genen opnieuw uitgeschakeld. De resultaten bevestigen dat DNA-methylering de genactiviteit direct reguleert.
“We hebben heel duidelijk aangetoond dat als je de ‘spinnenwebben’ verwijdert, het gen weer actief wordt”, zegt hoofdauteur Merlin Crossley van de Australische universiteit. “Toen we de methylgroepen weer aan de genen toevoegden, werden ze weer uitgeschakeld. Deze verbindingen zijn dus geen ‘spinnenwebben’, maar ankers.”
De nieuwste versie van CRISPR, bekend als epigenetische bewerking, hanteert een andere aanpak. In plaats van DNA te knippen, richt de techniek zich op chemische ‘vlaggen’ die aan genen in de celkern zijn gekoppeld. Door methylgroepen te verwijderen van genen die zijn uitgeschakeld, kunnen onderzoekers de genactiviteit herstellen zonder de onderliggende DNA-sequentie te veranderen.
Crossley: “Elke keer dat je DNA knipt, bestaat er een risico op kanker (en andere mutagene reacties; as). Als je een gentherapie uitvoert voor een chronische ziekte, is dat een ernstig risico. Als we echter gentherapie kunnen uitvoeren zonder DNA-strengen te knippen, vermijden we deze potentiële foutenbronnen.”
In plaats van DNA te knippen, gebruikt de nieuwe techniek een aangepast CRISPR-systeem om enzymen toe te dienen die methylgroepen verwijderen. Dit proces heft de genetische remmen op die bepaalde genen uitgeschakeld houden.
Een belangrijk doelwit in dit onderzoek was het foetale globine-gen, dat helpt bij het transport van zuurstof vóór de geboorte. Het reactiveren van dit gen na de geboorte zou defecten in het volwassen globine-gen, die sikkelcelziekte veroorzaken, kunnen omzeilen. Crossley: “Je kunt het foetale globinegen zien als de zijwieltjes op een kinderfiets. We denken dat we ze weer aan de praat kunnen krijgen bij mensen die nieuwe wieltjes nodig hebben.”
Meer ziektes
Medeauteur Kate Quinlan zegt dat de bevindingen verstrekkende gevolgen kunnen hebben, ook buiten sikkelcelziekte. Veel genetische aandoeningen hebben te maken met genen die onjuist aan- of uitgeschakeld zijn en het aanpassen van methylgroepen zou een manier kunnen bieden om die problemen te corrigeren zonder het DNA te beschadigen.
“We zijn enthousiast over de toekomst van epigenetische bewerking, omdat ons onderzoek aantoont dat die ons in staat stelt de genexpressie te stimuleren zonder de DNA-sequentie te wijzigen. Therapieën gebaseerd op deze technologie zullen waarschijnlijk een lager risico op onbedoelde negatieve effecten hebben. De effecten zijn aanzienlijk beter dan die van de eerste of tweede generatie CRISPR.”
De onderzoekers beschrijven al hoe de therapie in de praktijk zou kunnen werken. Artsen zouden de bloedstamcellen van een patiënt verzamelen, die rode bloedcellen produceren. In het labm zou epigenetische bewerking worden gebruikt om methylgroepen van het foetale globine-gen te verwijderen en het te reactiveren. De bewerkte cellen zouden vervolgens worden teruggeplaatst in de patiënt, waar ze zich in het beenmerg zouden kunnen nestelen en gezondere bloedcellen zouden kunnen gaan produceren.
De onderzoekers zijn van plan de aanpak te testen in diermodellen en verder onderzoek te doen naar andere op CRISPR gebaseerde methoden. Crossley: “Misschien wel het belangrijkste is dat het nu mogelijk is om moleculen te richten op individuele genen. Hier hebben we methylgroepen verwijderd of toegevoegd, maar dat is nog maar het begin. Er zijn nog andere veranderingen mogelijk die onze mogelijkheden om de genactiviteit te beïnvloeden voor therapeutische en agrarische doeleinde.”
Bron: Science Daily
