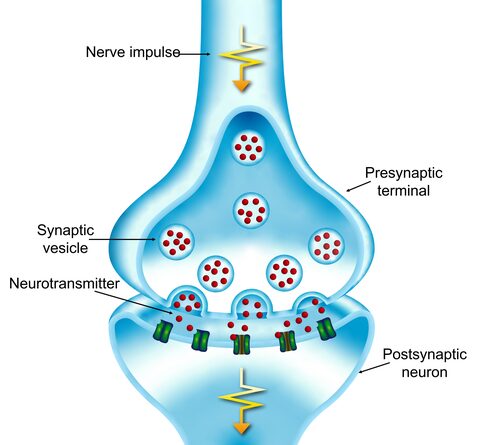
Chemische en elektrische signalen worden via synapsen aan andere hersencellen doorgegeven ((afb: OIST)
Onderzoekers van het instituut voor fundamenteel onderzoek (IBS) hebben een opmerkelijk piepklein maar cruciaal stukje genetische code gevonden (mini-exon B) dat helpt bepalen hoe hersencellen verbinding maken, communiceren en functioneren. De ontdekking verdiept niet alleen het begrip van hoe de bedrading van de hersenen is opgebouwd, maar verklaart mogelijk ook de oorsprong van verschillende neurologische en psychiatrische aandoeningen.
De studie, uitgevoerd door het centrum voor synaptische hersenziektes van het IBS en geleid door Eunjoon Kim , richtte zich op een eiwit genaamd PTPδ – een eiwit dat neuronen helpt bij het vormen van synapsen (de verbindingen tussen hersencellen). Hoewel PTPδ al in verband is gebracht met aandoeningen zoals autismespectrumstoornis, ADHD en het rustelozebenensyndroom, hebben de onderzoekers nu ingezoomd op een nog niet eerder onderzocht detail: een klein segment dat bekendstaat als mini-exon B.
Dit mini-exon wordt ontstaat bij het splitsingsproces, waarbij het spiegelbeeld van een gen (in de vorm van RNA) wordt ontdaan van overbodige sequentie zoals exonen en andere sequenties worden toegevoegd: het ‘fatsoeneren’ van boodschapper-RNA om als mal te dien voor eiwitten. Mini-exon B is slechts vier aminozuren lang, maar de onderzoekers ontdekten dat het een verrassend grote rol speelt in de ontwikkeling en het gedrag van de hersenen.
Het vermogen van de hersenen om te denken, voelen en bewegen hangt af van een delicate balans van elektrische en chemische signalen. Deze signalen reizen via synapsen, waar het ene hersencel een bericht doorgeeft aan het volgende. Eiwitten zoals PTPδ helpen deze synapsen correct te vormen door te fungeren als moleculair klittenband: ze verbinden neuronen met een precieze uitlijning.
De onderzoekers verwijderden de sequentie voor het mini-exon B uit het PTPδ-gen van de muisjes. De gevolgen waren dramatisch. Zonder mini-exon B hadden de muisjes een overlevingskans van minder dan 30% na de geboorte. Muisjes met één aangepaste kopie (van de twee) van het gen daarentegen overleefden tot in de volwassenheid, maar vertoonden duidelijke gedragsveranderingen, waaronder angstig gedrag (is dat niet normaal voor muisjes? as) en verminderde beweging.
De hersenopnamen van de beestjes lieten ook een disbalans in de synaptische activiteit zien. Granulecellen (granulocyten) – witte bloedlichaampjes die verantwoordelijk zijn voor informatieverwerking, zegt het persbericht – ontvingen zwakkere activerende signalen, terwijl interneuronen (schakelcellen), die de hersenactiviteit helpen controleren, sterkere activerende signalen ontvingen. Deze onbalans tussen activering en remming is een belangrijk kenmerk van verschillende neurologische en psychiatrische stoornissen.
Verstoorde activering
Om te achterhalen hoe dit piepkleine molecuul dat voor elkaar krijgt, onderzochten de onderzoekers de eiwitten die wisselwerken met PTPδ. Ze ontdekten dat PTPδ een moleculair complex vormt met een ander eiwit, IL1RAP, maar alleen wanneer mini-exon B aanwezig is. Zonder dit mini-exon verliest PTPδ zijn vermogen om IL1RAP te activeren, waardoor een wezenlijke voorwaarde voor de activering van synapsen wordt verstoord.
Deze wisselwerking bleek afhankelijk van het celtype te zijn. De mate van specificiteit verklaart waarom de vernietiging van mini-exon B sommige delen van de hersenen meer beïnvloedt dan andere.
Eunjoon: “Deze studie illustreert hoe zelfs het kleinste genetische element de balans van neurale circuits kan doen doorslaan. Het is een overtuigende herinnering aan het feit dat fouten in de alternatieve splitsing ingrijpende gevolgen kunnen hebben bij hersenaandoeningen.”
Dit zou de eerste in-vivostudie zijn die de functie van mini-exon B van PTPδ aantoont. De bevindingen dragen bij aan het groeiende bewijs dat verstoringen in microexon-splitsing mogelijk ten grondslag zouden kunnen liggen aan verschillende neuropsychiatrische aandoeningen.
Aandoeningen zoals autisme en ADHD worden steeds vaker in verband gebracht met een verstoorde synaptische ontwikkeling en deze studie helpt een mechanisme te verklaren waardoor dit zou kunnen gebeuren. Het (b)lijkt belangrijk niet alleen de genen zelf te bestuderen, maar ook de kleine onderdelen daarvan in hoe die processen (kunnen) beïnvloeden, beklemtonen de onderzoekers.
Vooruitkijkend kunnen deze inzichten de ontwikkeling van therapieën ondersteunen die gericht zijn op de regulatie van splitsingsproces of die helpen bij het herstellen van de normale synaptische balans bij getroffen personen.
Bron: Alpha Galileo
