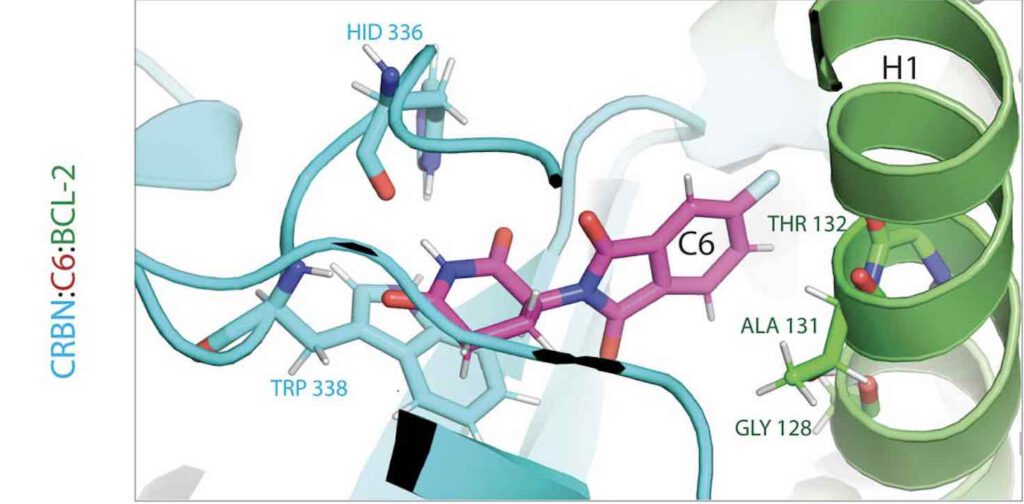
C6, een van de drie Thalomidederivaten van Cheng c.s., bindt merker CBRN ook aan gemuteerde BCL-2-eiwitten (afb: Xinlai Chen et. al/Cell)
Er is waarschijnlijk geen medicijn dat in de lage landen meer turbulentie en angst heeft veroorzaakt dan Softenon (‘zondagse’ naam thalidomide), Softenon is een merknaam), het slaapmiddel en de pijnstiller die het ongeboren leven drastisch verminkte. Overigens wordt het middel nog steeds tegen een groot aantal ziektes ingezet ook tegen kanker. Zo zou het middel de bloedvataanwas in tumoren remmen en daarmee de kankercellen doden. Thalodomide zou zeer effectief zijn tegen multipele myeloom (ook wel ziekte van Kahler genoemd) en andere beenmergkankers. Nu hebben onderzoekers in Duitsland drie thalidomideachtige verbindingen ontwikkeld die effectief zouden kunnen zijn tegen kanker.
“Thalidomide wordt gezien als moleculaire lijm”, zegt Xinlai Cheng van de Goethe-universiteit in Frankfort. “Dat betekent dat die verbinding zich kan binden aan twee eiwitmoleculen en die bij elkaar houdt.” Dat zou vooral belangrijk zijn als een van die eiwitten een ‘merker’ is die, bijvoorbeeld, aangeeft: dit is afval.
Dat signaal wordt opgepikt door het afvalverwerkingssysteem van de cel. Het bijbehorend eiwit wordt vervolgens in (herbruikbare) stukken gesneden. Cheng: “Die werking verklaart veel van de effecten van thalidomide. Afhankelijk van het gemerkte eiwit kan dat leiden tot misvorming in de embryonale ontwikkeling of ook tot het doden van kwaadaardige cellen.”
Kankercellen zijn voor hun woekergroei afhankelijk van bepaalde eiwitten. Als je die vernietigt zouden die kankercellen niet overleven, is de gedachte. Een van de te hechten eiwitten heeft altijd een signaalfunctie: de E3-ligase CRBN. Slechts een paar van de vele duizenden eiwitten in ons lijf komen in aanmerking als ‘partner’ (dat verschilt per soort lijm).
Daarom synthetiseerden Cheng en zijn collega’s een hele serie thalidomide-achtige verbindingen. “We onderzochten die op hun lijmeigenschappen en bij welke eiwitten ze effectief waren.” Dat deden ze in celkweken. Vervolgens keken ze of die eiwitten werden versnipperd in aanwezigheid van CRBN.
“Drie van die thalidomideachtige verbindingen konden een eiwit markeren dat zeer belangrijk is voor de (eiwit-; as) afbraak: BCL-2. Dat voorkomt de activering van van het celprogramma van zelfvernietiging. Als dat eiwit niet aanwezig is dan is het einde cel.” Daarom staat dat eiwit/gen ook in de belangstelling van veel kankeronderzoekers. Er is zelfs al een middel om leukemie te behandelen (venetoclax). Venetoclax beperkt de werking van BCL-2 waardoor de gemuteerde cellen afsterven.
Gemuteerd BCL-2
Cheng: “In veel kankersoorten is het BCL-2-gen echter gemuteerd. Dan remt venetoclax dat eiwit niet meer. Dat gebeurt wel met onze thalidomide-afgeleiden. Onze collega’s bij het Max Planckinstituut voor biofysica hebben op de computer de wisselwerking gesimuleerd tussen die verbindingen (C5, C6 en C7 gedoopt; as) en BCL-2. Het blijkt dat onze thalidomide-verbindingen op heel andere plaatsen van het eiwit binden dan venetoclax, wat later ook uit experimenten bleek.”
De onderzoekers probeerden de drie thalidomide-afgeleiden in fruitvliegjes met kankercellen. Die verhoogden de overlevingskans van de kankervliegjes aanzienlijk (die kunnen maximaal vier maanden oud worden; het zijn geen eendagsvliegjes). Overigens wil dat nog niet meteen zeggen dat dat middel ook in de kliniek bij mensen werkt, waarschuwt Cheng. “Dit is toch vooral fundamenteel onderzoek.”
Bron: Alpha Galileo
