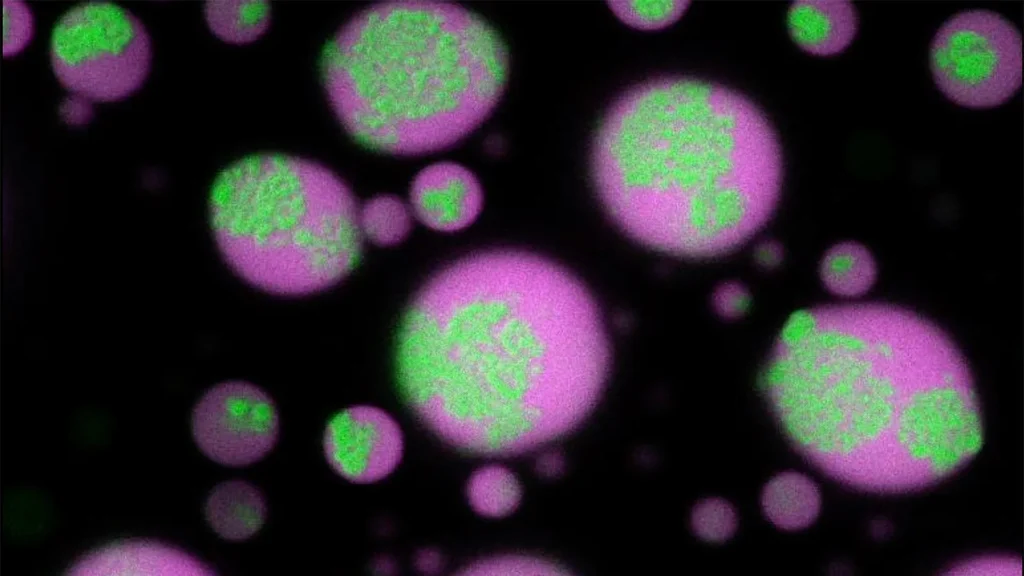
RNA-klonteringen(groen) vallen geleidelijk uiteen in biomoleculaire condensaten (magenta), waardoor het RNA weer oplosbaar wordt. Dit gebeurde nadat een antisense-oligonucleotide, ontwikkeld door het team van Priya Banerjee, aan het condensaat werd toegevoegd. (afb: Universiteit van Buffalo)
Wetenschappers hebben ontdekt hoe bepaalde eiwitklonteringen in de hersens ontstaan en hebben ook een oplossing daarvoor bedacht. en laten ze verdwijnen. Eiwitklonteringen in de hersens komen voor bij de ziektes van Alzheimer, van Parkinson en naar het schijnt (ik=as was me er niet van bewust) ook bij ALS (amyotrofe laterale sclerose) en de ziekte van Huntington.
Bij de laatste twee ziektes gaat het om kleverige RNA-kluwens die kleine vloeistofachtige druppeltjes vormen in cellen en die lang kunnen blijven bestaan, ook nadat hun omgeving is verdwenen. Door introductie van het kleverige eiwit G3BP1, konden de onderzoekers de vorming van de RNA-klonteringen stoppen en met een speciaal ontworpen stukje RNA (ASO, in afko) konden ze die zelfs oplossen. Overigens is het mij niet duidelijk wat de verwijdering van die klonteringen voor de ziek(t)e betekent.
Kijk in een hersencel met de ziekte van Huntington of ALS en je zult er waarschijnlijk samengeklonterde RNA’s aantreffen. Deze klonteringen, die onomkeerbaar geacht worden, kunnen fungeren als sponzen die omliggende eiwitten opzuigen die belangrijk zijn voor de gezondheid van de hersenen en bijdragen aan neurologische aandoeningen. Hoe is nog steeds niet bekend.
Onderzoekers van de universiteit van Buffalo hebben nu niet alleen ontdekt dat kleine druppeltjes eiwit en nucleïnezuren in cellen bijdragen aan de vorming van RNA-klonteringen, maar ook een manier gevonden om die clusters te voorkomen en op te ruimen. De onderzoekers maakten daarbij gebruik van een gemanipuleerde RNA-streng, een zogenaamde antisense-oligonucleotide (ASO), die zich aan RNA-clusters kan hechten en deze kan verspreiden.
“Het is fascinerend om te zien hoe deze klonteringen onder de microscoop zich in de loop van de tijd vormen in dichte, druppelachtige mengsels van eiwit en RNA”, zegt Priya Banerjee. “Net zo opvallend is dat de clusters oplossen wanneer antisense-oligonucleotiden de RNA-aggregaten uit elkaar trekken. Wat zo spannend is aan deze ontdekking, is dat we niet alleen hebben ontdekt hoe deze klonters zich vormen, maar ook een manier hebben gevonden om ze uit elkaar te halen.”
Druppeltjes
Cellen maken deze vloeistofachtige druppeltjes van RNA, DNA en eiwitten – of een combinatie van alle drie. Banerjee en zijn collega’s hehben die mysterieuze druppeltjes uitgebreid onderzocht, waarbij ze hun rol in zowel cellulaire functies als ziekten hebben onderzocht, evenals hun fundamentele materiële eigenschappen die nieuwe mogelijkheden bieden voor toepassingen in de synthetische biologie.
De condensaten worden in wezen gebruikt als gastheren door herhaal-RNA-herhalingen, aan ziekten gekoppelde RNA-moleculen met abnormaal lange strengen van herhaalde sequenties. In een vroeg stadium blijven de herhaal-RNA’s volledig gemengd in deze condensaten, maar naarmate de condensaten ouder worden, beginnen de RNA-moleculen samen te klonteren, waardoor een RNA-rijke vaste kern ontstaat, omgeven door een RNA-arme vloeibare schil.
“Herhaal-RNA’s zijn van nature plakkerig, maar interessant genoeg plakken ze niet zomaar aan elkaar, omdat ze zich vouwen tot stabiele 3D-structuren. Ze hebben de juiste omgeving nodig om zich te ontvouwen en samen te klonteren en de condensaten zorgen daarvoor”, aldus hoofdauteur Tharun Selvam Mahendran, promovendus in het laboratorium van Banerjee.
“Cruciaal is ook dat we ontdekten dat de vaste, herhalende RNA-clusters blijven bestaan, zelfs nadat het condensaat van de gastheer is opgelost. Deze persistentie is deels de reden waarom men denkt dat het klonterproces onomkeerbaar zou zijn.”
G3Bp1
De onderzoekers konden voor het eerst aantonen dat de vorming van herhalende RNA-clusters kan worden voorkomen door gebruik te maken van een RNA-bindend eiwit, bekend als G3Bp1, dat aanwezig is in cellen.
Banerjee: “RNA-clusters ontstaan doordat de RNA-strengen aan elkaar plakken, maar als je een ander kleverig element, zoals G3BP1, aan het condensaat toevoegt, worden de interacties tussen de RNA’s verstoord en stopt de clustervorming. Het is alsof je een chemische remmer in een kristalvormende oplossing gooit: de ordening wordt verstoord. Je kunt G3BP1 zien als een oplettende moleculaire chaperonne die zich aan de kleverige RNA-moleculen bindt en ervoor zorgt dat de RNA’s niet aan elkaar plakken.”
Om de klonteringen op te ruimen, gebruikten de onderzoekers een antisense-oligonucleotide. Omdat ASO een kort RNA is met een sequentie die complementair is aan de herhaal-RNA, kon het niet alleen binden aan de aggregatiegevoelige RNA’s, maar ook de RNA-clusters demonteren.
Ze zagen ook dat de opruimcapaciteiten van de ASO nauw verbonden waren met zijn specifieke basevolgorde. “Dit suggereert dat de ASO kan worden aangepast om zich alleen te richten op specifieke herhaal-RNA’s, wat een goed teken is voor de haalbaarheid ervan als potentiële therapeutische toepassing”, zegt Banerjee.
Hij denkt dat deze experimenten laten zien dat RNA’s zijn geëvolueerd om deze verschillende vormen van materie aan te nemen. “Sommige daarvan zijn extreem nuttig voor biologische functies en misschien zelfs voor het leven zelf en andere kunnen ziektes veroorzaken.”
Bron: Science Daily
