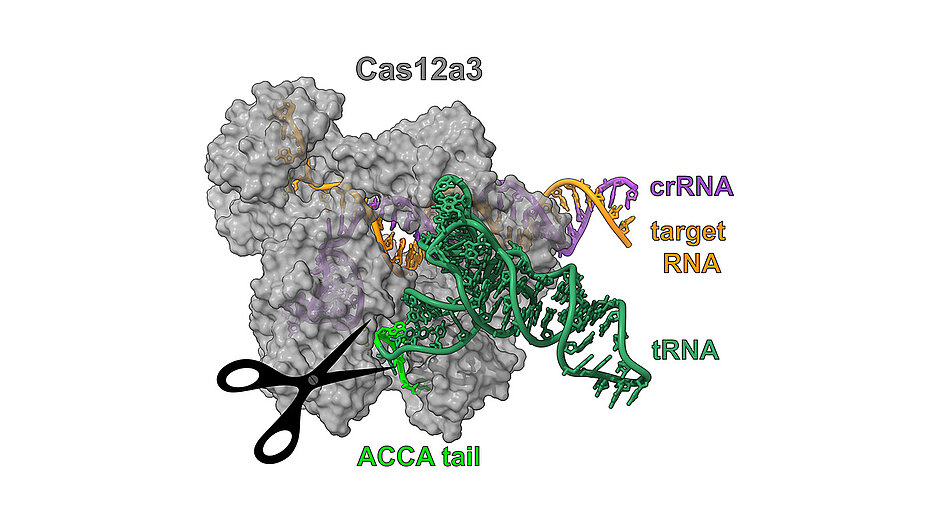
Structuur van Cas12a3 (afb: Biao Yuan / HZI)
Sinds ‘we’ CRISPR hebben geleend van bacteriën zijn wetenschappers over de hele wereld driftig bezig om dit instrument om genomen (mv van genoom) ook daadwerkelijk toe te passen en soms zijn die toepassingen ook al goedgekeurd voor klinisch gebruik. Onderzoekers hebben die CRISPR-gereedschapskist van de bacteriën nog maar mondjesmaat ingezet en nu komt er zo langzamerhand meer CRISPR-vormen boven water die elk zo weer hun eigen toepassingsgebieden hebben.
‘We’ zijn nog maar net begonnen de inhoud van die kist te inventariseren (stel ik=as heel brutaal). Onderzoekers van het Helmholtz-instituut voor RNA-gebaseerd besmettingsonderzoek (HIRI) in Würzburg hebben een compleet ander CRISPR-verdedigingsstrategie ontdekt: in tegenstelling tot bekende de bekende Cas-nucleasen (‘genscharen’) splitst Cas12a3 specifiek transfer-ribonucleïnezuur (tRNA), dat essentieel is voor de eiwitsynthese, om besmette cellen uit te schakelen.
Transfer-RNA’s zijn aanwezig in alle cellen en spelen een grote rol bij de vertaling van boodschapper-RNA (bRNA) in essentiële eiwitten. Door ze uit te schakelen, wordt de eiwitproductie verminderd of zelefs helemaal stopgezet, waardoor de besmette (=zieke) cel in een rusttoestand terechtkomt. Hierdoor kan de virale indringer en ziekteverwekker zich niet langer vermenigvuldigen en zich verspreiden.
Een veelvoorkomend bacterieel afweermechanisme dat voorheen niet in verband werd gebracht met tRNA-splitsing is het CRISPR-Cas-systeem. CRISPR gebruikt RNA-gerichte eiwitten, zogenaamde Cas-nucleasen (geassocieerd met CRISPR), om indringers te herkennen op basis van hun genetisch materiaal en ze selectief te neutraliseren.
Zodra ze een ziekteverwekker hebben geïdentificeerd, zetten de nucleasen een afweerreactie in gang die uniek is voor elk systeem. Dat kan bijvoorbeeld het knippen van specifiek indringer-DNA zijn of het initiëren van groeistop door middel van algehele RNA- en DNA-afbraak. Onderzoek heeft deze mechanismen al op verschillende manieren benut en CRISPR erkend als een belangrijke basis voor technologieën voor genoombewerking. Dat CRISPR-Cas ook bij voorkeur geeft aan tRNA’s als onderdeel van een afweerreactie was tot nu toe onbekend.
Onderzoekers van HIRI hebben in samenwerking met de Julius-Maximilians-universiteit in Würzburg (JMU) een nieuw CRISPR-mechanisme ontdekt dat zich specifiek richt op die tRNA’s. Samen met wetenschappers van het HZI en de universiteit van Utah (USU) hebben zij een nog onbekend CRISPR-mechanisme ontdekt dat zich precies op deze tRNA’s richt. “Deze ontdekking was volkomen onverwacht,” zegt Chase Beisel van HIRI. “Onze groep werkte eigenlijk aan eiwitten die geassocieerd zijn met de nuclease Cas12a2.”
Eerdere studies in januari 2023 beschreven hoe ze Cas12a2 ontdekten in een familie van nucleasen die uitsluitend DNA knipt. Cas12a2 bleek echter in staat om zowel RNA als DNA op grote schaal af te breken. “We veronderstelden dat deze eiwitfamilie wellicht nog andere bijzondere functies zou hebben en we bleken gelijk te hebben. Zo ontdekten we Cas12a3 met zijn unieke eigenschappen,” voegt mede onderzoeker Oleg Dmytrenko er aan toe.
Vreemde RNA-sequenties (?)
Hoewel Cas12a3, net als Cas12a2, ook RNA gebruikt om vreemde RNA-sequenties (???; as) te lokaliseren, zorgt een overeenkomst ervoor dat Cas12a3 van vorm verandert, zich specifiek bindt aan een staartgedeelte van het tRNA en daar zijn knipwerk verricht. “Deze precisie maakt Cas12a3 een exacte tegenhanger van zijn naaste verwant, Cas12a2, die breder knipt maar minder specifiek is,” zegt Ryan Jackson van de universiteit van Utah.
De zogenaamde 3′-staart is het best bewaarde deel van alle tRNA’s. Dit betekent dat het in veel organismen in de loop der tijden onveranderd is gebleven. Dit deel is cruciaal voor de functie en stabiliteit van het RNA en is daarom nauwelijks veranderd tijdens de evolutie. Daaraan is een geactiveerd aminozuur verbonden.
Tijdens de eiwitsynthese worden aminozuren, de bouwstenen van eiwitten, van het tRNA overgebracht naar een groeiende eiwitketen. Het verwijderen van de tRNA-staart is daarom een effectieve manier om de eiwitproductie te blokkeren, een essentieel proces voor de cel.
De structuur van Cas12a3, die onderzoekers met behulp van cryo-elektronenmicroscopie vastlegden, onthult hoe het nuclease tRNA’s herkent. “We hebben een uniek deel kunnen identificeren, dat we het ’tRNA-laaddomein’ hebben genoemd”, zegt Dirk Heinz, een andere medeonderzoeker. De functie ervan zou zijn om de 3′-staart van het tRNA precies op de juiste plek te positioneren voor de splitsing.
De onderzoekers konden deze hoge precisie direct benutten. Ze combineerden Cas12a3 met twee andere nucleasen die ook met uiterste precisie knippen, maar zich richten op andere specifieke RNA’s. Met deze combinatie konden ze tegelijkertijd RNA’s van drie verschillende virussen detecteren: het griepvirus, het respiratoir syncytieel virus (RSV) en SARS-CoV-2 (het coronavirus). Beisel: “Dit stelde ons niet alleen in staat de grenzen van CRISPR-diagnostiek te verleggen, maar onze onderzoeksresultaten zouden ook goedkopere en eenvoudig uit te voeren proeven mogelijk maken voor een breed scala aan ziekten.”
Nieuwe werkterreinen
Het splitsen van tRNA-staarten vertegenwoordigt een niet eerder ontdekte CRISPR-afweerreactie en toont de diverse manieren waarop bacteriën zich tegen virusbesmettingen kunnen verdedigen. Dit werk zou de enorme functionele diversiteit weergeven die verborgen liggen in reeds bekende bacteriële afweermechanismen.
De onderzoekers zijn daar al mee bezig. Heinz: “In de hoop verdere variaties te ontdekken, willen we dit kleine segment van CRISPR-afweermechanismen nog verder uitpluizen.” Bovendien zou Cas12a3 bruikbaar zijn te maken voor diagnostiek en andere toepassingen.”
Bron: idw-online.de
