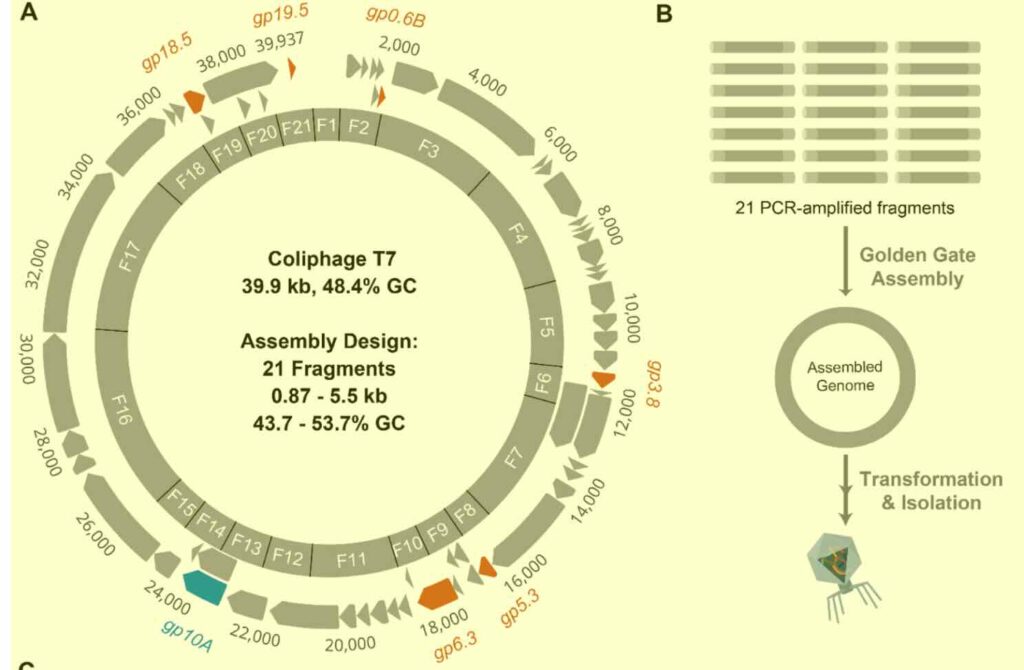
In deze methode wordt stukjes faag-DNA letter voor letter ‘opgebouwd’ waarna de DNA-stukken (hier 21) aaneen worden ‘gelast’. Rechtsonder de uieindelijke faag. (afb: Andy Sikkema et al./ACS Synthetic Biology)
Onderzoekers van New England Biolabs (NEB) en de Yale-universiteit zouden het eerste volledig kunstmatige systeem hebben ontwikkeld voor het ‘bouwen’ van bacteriofagen (letterlijk bacterievreters) voor Pseudomonas aeruginosa. Die bacterie is over de hele wereld ongevoelig geworden voor antibiotica en dat is niet goed (voor de mens, die overigens zelf heeft gezorgd voor die resistentie). Daarbij is het HC-GGA-platform van NEB gebruikt. Daarmee kunnen onderzoekers bacteriofagen ‘bouwen’ met behulp van DNA-sequenties in plaats van het assembleren van (grotere) stukken bestaand DNA-erfgoed.Bacteriofagen, virussen die bacteriën besmetten, worden al meer dan 100 jaar gebruikt voor behandeling voor bacteriële infecties. De interesse in deze virussen neemt weer toe nu antibioticaresistentie een groeiende bedreiging voor de wereldwijde volksgezondheid vormt.
Ondanks deze hernieuwde aandacht is het meeste fagenonderzoek gericht gebleven op van nature voorkomende virussen, voornamelijk omdat traditionele methoden voor het modificeren van fagen traag, complex en moeilijk op te schalen zijn.
In dit nieuwe onderzoek zouden de wetenschappers het eerste volledig synthetische systeem voor het ‘bouwen’ van bacteriofagen hebben ontwikkeld voor de bestrijding van de resistente Pseudomonas aeruginosabacterie. Het faag’bouwwerk’ bestaat uit 28 synthetische DNA-fragmenten. Vervolgens programmeerden ze het virus met nieuwe mogelijkheden door puntmutaties in de DNA-streng door te voeren. Deze veranderingen stelden hen in staat om genen voor staartvezels*) te verwisselen, waardoor de bacteriën die de faag kon besmetten veranderden. Ook konden ze fluorescerende ‘vlaggen’ toevoegen die besmettingen direct zichtbaar maakten.
“Zelfs in de beste gevallen is het ontwikkelen van bacteriofagen extreem arbeidsintensief geweest”, zegt medehoofdauteur Andy Sikkema van NEB. “Onderzoekers hebben hun hele loopbaan besteed aan het ontwikkelen van processen om specifieke modelbacteriofagen in gastheerbacteriën te creëren. Deze synthetische methode biedt technologische sprongen voorwaarts qua eenvoud, veiligheid en snelheid en effent de weg voor biologische ontdekkingen en de ontwikkeling van therapieën.”
Met het HC-GGA-platform kunnen onderzoekers een volledig faaggenoom buiten de cel ‘bouwen’ naar believen. Na de samenstelling wordt het genoom toegevoegd in een veilige labfaag, waarmee het een actieve bacteriofaag wordt.
Tijdbesparing
Dat zou een hoop tijdbesparing opleveren. Traditionele benaderingen zijn afhankelijk van het bewaren van fysieke faagmonsters en het gebruik van gespecialiseerde gastheerbacteriën, wat vooral lastig kan zijn bij het werken met gevaarlijke micro-organismen. De nieuwe methode elimineert ook de noodzaak voor herhaalde doorlichtrondes of stapsgewijze genetische aanpassingen in levende cellen.
Anders dan andere DNA-assemblagetechnieken, die minder maar langere fragmenten aaneenlassen, gebruikt deze methode kortere DNA-segmenten. Deze kortere stukken zijn gemakkelijker te produceren, minder toxisch voor gastheercellen en bevatten, in theorie, ook minder snel fouten. De methode werkt ook goed met faaggenomen die herhaalde sequenties of een extreem hoog GC-gehalte (de DNA-‘letters’ voor guanine en cytosine) hebben, factoren die DNA-assemblage vaak bemoeilijken.
Door het proces te vereenvoudigen en de technische mogelijkheden te vergroten, vergroot deze aanpak de potentie voor de ontwikkeling van bacteriofagen als gerichte therapieën tegen antibioticaresistente infecties aanzienlijk. “Mijn lab bouwt ‘vreemde hamers’ en zoekt dan naar de juiste spijkers”, stelt medeonderzoeker Greg Lohman van NEB. “In dit geval vertelde de faagtherapie-gemeenschap ons: ‘Dat is precies de hamer waar we op hebben gewacht.'”
*) Staartfagen gebruiken een breed scala aan receptorbindende eiwitten, zoals staartvezels, staartuitsteeksels en de centrale staartuitsteeksel, om zich te richten op hun specifieke bacteriële celreceptoren. Recente technologische vooruitgang en nieuwe inzichten in structuur-functie hebben de moleculaire mechanismen en de temporele dynamiek die deze interacties beheersen, aan het licht gebracht. (Komt uit Nature-artikel van 2018).
Bron: Science Daily
