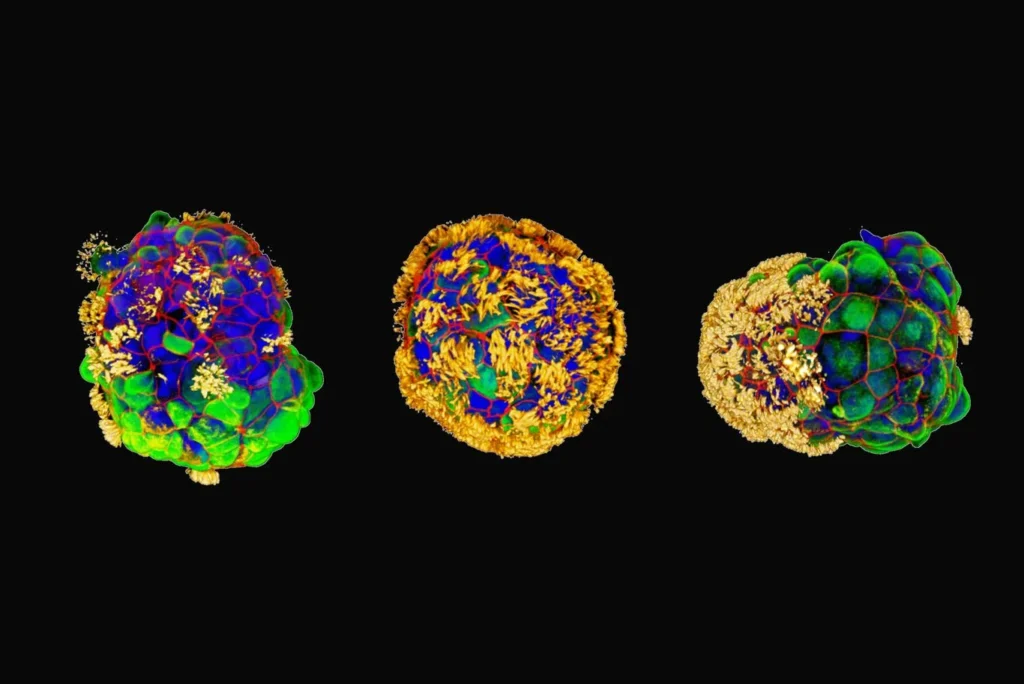
Drie antrobots met trilhaartjes (geel) (afb: Gizem Gumuskaya/Tufts)
Onderzoekers rond Michael Levin van de Amerikaanse Tuftsuniversiteit hebben van (menselijke) cellen uit de luchtpijp meercellige ‘robots’ gemaakt die in het lab (dus niet in een menselijk lichaam) opzettelijk aangebrachte schade aan zenuwcellen hielpen genezen. Deze, wat de onderzoekers antrobots noemen, celstructuren zouden in de toekomst gebruikt kunnen worden bij genezing en herstel van weefsel. Al eerder waren soortgelijke resultaten behaald met ‘biorobots’ van kikkercellen (‘xenobots’ gedoopt). Het programmeren van die antrobotcellen zou nog extra mogelijkheden scheppen, denken de onderzoekers.
Die xenobots van embryocellen van kikkers bleken zich te bewegen, materiaal te verzamelen, informatie op te slaan en zichzelf te genezen (schade te herstellen) en zichzelf zelfs een paar keer te repliceren (delen). Of dat niet kwam doordat dat vreemde (xeno is Grieks voor vreemd) cellen waren wisten de onderzoekers niet.
Om dat uit te zoeken gebruikten ze nu cellen van volwassen mensen (uit de luchtpijp). Die werden niet genetisch veranderd en bleken het nog beter te doen dan de kikkerbots. Die ontdekking is volgens Levin en de zijnen een begin van een antwoord op de vraag: welke regels gelden er als cellen samengroeien en -werken? Kunnen cellen uit hun natuurlijke omgeving worden gehaald en samengevoegd in een ander ‘lichaamsplan’ om gericht andere functies te verrichten?
“We wilden kijken wat cellen nog anders kunnen doen dan de eigenlijke functies”, zegt hoofdauteur Gizem Gumuskaya, die voor hij biologie studeerde een architectenopleiding had afgerond. “Als je de interacties tussen cellen herprogrammeert, dan krijg je nieuwe meercellige structuren net zoals je van stenen allerlei vormen kunt maken.”
De onderzoekers zagen dat ze niet alleen nieuwe vormen konden maken, maar ook dat die bots op verschillende manieren over de gekweekte menselijke zenuwcellen konden bewegen om groei te bevorderen na aangebrachte schade aan die zenuwcellen.
Hoe dat allemaal in zijn werk gaat is nog onduidelijk, maar de (beschadigde) zenuwcellen werden overdekt met een kluit antrobots. Natuurlijk is in een celkweek meer mogelijk dan in het (menselijke) lichaam, dus de vraag blijft nog open of dat ook zo in het lichaam werkt. Levine: “Het is verrassend en volledig onverwacht dat menselijke luchtpijpcellen zonder ze genetisch te veranderen kunnen bewegen en het herstel van zenuwcellen helpen genezen. We moeten nu uitvinden hoe dat werkt en kijken welke mogelijkheden er zijn.”
Een klein probleempje is natuurlijk dat die antrobots alleen in leven blijven onder speciale labomstandigheden. Dat is ook een voordeel, want dan komen die bots ook niet buiten het lab en vormen dus ook geen gevaar voor wat dan ook, stellen de onderzoekers. Dat wordt natuurlijk anders als ze ook in het lichaam worden ingezet.
Meer mogelijkheden
De onderzoekers willen nu kijken of er meer mogelijk is met deze mensenbots, zoals een samenstelling uit verschillende cellentypen. Ook overwegen ze om de cellen genetisch te veranderen. Mogelijk kunnen die celconstructies helpen bij het opruimen van plaques, het herstel van een beschadigd ruggenmergweefsel, het herkennen van bacteriën of kankercellen of het afleveren van medicijnen.
Gumuskaya legt uit dat cellen een ‘aangeboren’ vermogen hebben tot zelfassemblage in grotere structuren. “Ze kunnen lagen vormen, gezamenlijk vouwen, bollen maken zich scheiden op basis van type, samenvoegen en zelfs bewegen. Twee grote verschillen met dood materiaal als stenen is dat cellen communiceren met elkaar en dynamische structuren kunnen vormen. “Elke cel is geprogrammeerd voor vele functies zoals beweging, scheiding van moleculen, signaalmeting en nog meer. We zijn nog maar net bezig uit te zoeken hoe we die elementen kunnen combineren om nieuwe biologische ‘lichaamsplannen’ en functies te creëren die in de natuur niet voorkomen.”
Niet alleen dat, maar dit (soort) onderzoek zou er zo ook achter kunnen komen hoe al die natuurlijke processen zoals zelfassemblage werken, hoe het genoom samenwerkt met de omgeving, hoe weefsels, organen ledematen worden gevormd en hersteld (of niet zoals bij beschadigd ruggemergweefsel) en ga zo maar door. Er valt nog veel te onderzoeken aan het leven.
Bron: Science Daily
