Eiwitafbraak, de ontsleuteling van de ubiquitinecode (afb: Leo Kiss et al./Molecular Cell)
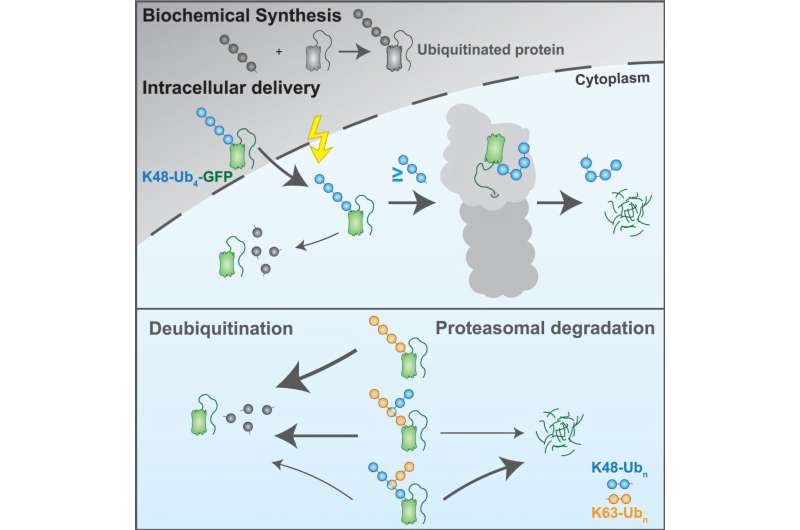
Ubiquitine markeert eiwitten voor afbraak, waarbij ubiquitine-moleculen op verschillende manieren en in verschillende aantallen kunnen worden gecombineerd en ketens met vertakkingen kunnen vormen. Onderzoekers van het Max Planckinstituut voor biochemie hebben een nieuwe -technologie (UbiREAD gedoopt) ontwikkeld om de verschillende combinaties van ubiquitinmoleculen te ontcijferen (de ubiquitincode) die bepalen hoe eiwitten in cellen worden afgebroken.Met behulp merkten de onderzoekers fluorescerende eiwitten met specifieke ubiquitincodes en volgden toen hun gangen. Zo kwamen ze erachter welke ubiquitincode welke (of geen) gevolgen hebben.
Eiwitten zijn de bouwstenen van het leven en onderhouden de celstructuur en -functie. Wanneer eiwitten echter beschadigd, verkeerd gevouwen of verstoord raken, kunnen ze leiden tot een reeks ziekten, van Alzheimer en Parkinson tot kanker en spierdystrofie (en zo voort). Om dit te voorkomen, hebben cellen een mooi systeem ontwikkeld om ongewenste eiwitten te markeren voor afbraak met een klein eiwit (ubiquitine, dus).
Ubiquitine geeft aan wat er met dat eiwit moet gebeuren. De ubiquitinecode kan een enkele ubiquitinemolecuul zijn of enkele ubiquitinen die aan elkaar zijn gekoppeld.
Hoofdauteur Leo Kiss legt het uit: “De ubiquitinecode is echt fascinerend vanwege de complexiteit ervan: het koppelen van één ubiquitinemolecuul aan een ander kan op acht verschillende manieren gebeuren. Deze bevestigingen kunnen meermalen worden herhaald, waardoor ketens van verschillende lengtes ontstaan.
“Alsof dat nog niet complex genoeg is, kunnen verschillende soorten ketens zich aftakken van bestaande ketens. Met zoveel mogelijkheden begrijpen we de informatie die deze structuren coderen nog niet helemaal (of is het helemaal niet? as). Dat is waar onze technologie om de hoek komt kijken: die fungeert als een lezer die kan decoderen wat deze verschillende ubiquitineketens in cellen doen.”
De complexiteit van de ubiquitinecode vormt een aanzienlijk probleem voor onderzoekers die eiwitafbraak bestuderen. De verschillende combinaties van ketentypen, lengtes en vormen resulteren in een groot aantal codes die moeilijk te ontcijferen zijn .
Een van de grootste obstakels is het ontbreken van een systematische aanpak om eiwitafbraak in cellen te observeren. Huidige methoden hebben zo hun beperkingen. Die situatie heeft geleid tot tegenstrijdige resultaten in verschillende onderzoeken.
UbiREAD
Om deze ubiquitinecode te ontrafelen hebben Kiss en collega’s dus UbiREAD (
ge-ubiquineerde verslaggever, evaluatie na intracellulaire afgifte, maar dan in het Engels) .
Deze techniek maakt het mogelijk om de afbraak van eiwitten met een bepaalde ubiquitinecode te bestuderen.
De onderzoekers merken een fluorescerend eiwit met een bekende ubiquitinecode. Vervolgens leveren ze het gemerkte fluorescerende eiwit af aan de cellen. Op basis van de fluorescentie-intensiteit, die correleert met de hoeveelheid eiwit, kunnen ze de loop van het eiwit volgen. Als dat nog intact is, blijft de fluorescentie, als het wordt afgebroken verdwijnt de fluorescentie.
Met behulp van UbiREAD ontdekten onderzoekers dat intracellulaire afbraak sneller is dan de afbraak van hetzelfde substraat in een reageerbuis met gezuiverde afbraakapparatuur. Het duurt slechts een minuut om de helft van het gemerkte eiwit in een cellulaire omgeving af te breken. Bovendien konden ze aantonen dat eiwitten die zijn gemerkt met een specifiek type ubiquitineketen, genaamd K48, snel worden afgebroken, terwijl eiwitten die zijn gemerkt met K63 snel hun merk verliezen en afbraak ontlopen.
De onderzoekers vergeleken ook verschillende ubiquitineketenlengtes. Kiss: “Verrassend genoeg waren al drie ubiquitinemoleculen voldoende om het fluorescerende eiwit effectief af te breken. Deze code kan echter verloren gaan wanneer deze ubiquitinen niet rechtstreeks op het substraat worden gevormd, maar op een andere ubiquitineketen. De exacte context is van belang.”
Ik(=as) zal wel een zeikerd zijn, maar wat hebben de onderzoekers eigenlijk ontcijferd? De ubiquitinecode (o.i.d.) ja, maar wel mechanisme bepaalt de hoeveelheid ubiquitines en hoe die aan een misvormd eiwit moeten hangen. Dat lijkt mij toch niet onbelangrijk, om niet te zeggen de kern van de ondrzoeksvraag (of zeg ik iets geks?).
Bron: phys.org
