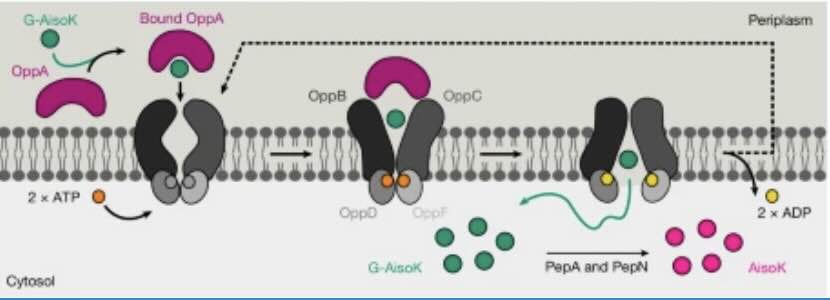
Het transportsysteem wordt ‘verleid’ om niet natuurlijke aminozuren in de E- coli-cel binnen te laten, waar die, na wat manipulatie, ook daadwerkelijke niet-natuurlijke eiwitten gaat aanmaken (afb: Kathrin Lang et al./Nature)
Het (ook ons) leven gebruikt maar twintig aminozuren om de werkpaarden van dat leven te bouwen: de eiwitten. Onderzoeksters van ETH Zürich hebben nu een bacterieel transportsysteem zo aangepast dat het efficiënt grote hoeveelheden onnatuurlijke aminozuren, vermomd als een Trojaans paard, in cellen kan aanmaken. Daardoor zouden eiwitten kunnen worden gemaakt met meer, andere functies dan de natuurlijke is de gedachte. Of dat echt zo is moet nog wel worden aangetoond.
Het nieuwe systeem maakt de efficiënte biotechnologische massaproductie van dergelijke synthetische eiwitten mogelijk. Toepassingen zouden kunnen variëren van nauwkeurig gerichte medicijnen en efficiëntere katalysatoren tot verbeterde beeldvormingstechnieken.
Dat beperkte gebruik van de mogelijke aminozuren zou, in theorie, in scheikundig opzicht een heel groot potentieel aan eiwitstructuren en daarmee functies ongebruikt laten. In het lab kunnen scheikundigen echter theoretisch duizenden niet-natuurlijke aminozuren ‘bereiden’, waarvan vele geheel nieuwe eigenschappen zouden kunnen hebben.
Biotechnologische methoden maken het mogelijk om deze kunstmatige bouwstenen specifiek in eiwitten van levende cellen in te bouwen. “Eiwitten met specifiek geplaatste kunstmatige aminozuren openen vele nieuwe mogelijkheden voor medische en industriële toepassingen, evenals voor wetenschappelijk onderzoek,” zegt chemisch biologe Kathrin Lang van de ETH Zürich nog maar weer eens.
Therapeutische eiwitten (medicijnen) kunnen preciezer en effectiever werken dankzij extra chemische groepen. Fluorescerende componenten of componenten met atomen zoals chloor of fluor, die normaal niet in eiwitten voorkomen, kunnen beeldvormingstechnieken in de geneeskunde en het onderzoek verbeteren.
Ook worden enzymen met nieuwe katalytische eigenschappen mogelijk, of maken specifieke vernettingsaminozuren de constructie van eiwitten mogelijk die efficiënt functioneren, zelfs onder extreme externe omstandigheden zoals hitte of druk. Bovendien maken speciale koppelingsgroepen het mogelijk om geneesmiddelen te binden aan dragereiwitten, die medicijnen betrouwbaar naar ziek weefsel zouden kunnen transporteren.
Inefficiënt
Tot nu toe is de gerichte inbouw van synthetische aminozuren in eiwitten aanzienlijk minder efficiënt gebleken dan de productie van eiwitten die uitsluitend bestaan uit de twintig natuurlijke aminozuren. Toepassingen zijn daarom grotendeels beperkt gebleven tot kleinschalige onderzoeksprojecten. Een belangrijk knelpunt: kunstmatige aminozuren bereiken de bacteriën die voor biotechnologische productie worden gebruikt vaak slechts in zeer kleine hoeveelheden.
De groep van Lang heeft nu een oplossing ontwikkeld die de efficiënte introductie van kunstmatige aminozuren in bacteriën mogelijk maakt. Dit maakt het mogelijk om het ‘werkterrein’ van aminozuren voor wijdverspreid gebruik in de geneeskunde en de biotechnologie-industrie uit te breiden. De onderzoeksters maakten gebruik van een natuurlijk transportsysteem van de bacterie Escherichia coli. Dit systeem zorgt er voor dat korte eiwitfragmenten, peptiden genaamd, vanuit in de cel terechtkomen.
Dit transportsysteem bestaat uit twee componenten: een kanaal in het celmembraan en een pendelcomponent. Deze pendelcomponent herkent peptiden van drie tot vier aminozuren lang en transporteert ze naar het kanaal, dat ze vervolgens in de cel aflevert. Daar worden de peptiden afgebroken tot hun afzonderlijke aminozuurbouwstenen, die vervolgens beschikbaar zijn voor de celmachinerie voor de synthese van nieuwe eiwitten.
Omdat het systeem moet functioneren voor alle natuurlijke aminozuurcombinaties, is het niet erg selectief. Peptiden die kunstmatige aminozuren bevatten, worden ook getransporteerd, hoewel vaak slechts in kleine hoeveelheden of helemaal niet.
Om het transportsysteem in staat te stellen grote hoeveelheden kunstmatige aminozuren te importeren, gebruikten de biochemici van ETH Zürich twee technieken. Ze verpakten de kunstmatige aminozuren in korte synthetische peptiden, waarin die omgeven zijn door natuurlijke bouwstenen. De transporteur laat deze vermomde lading gemakkelijk passeren. Die fungeert als een moleculair Trojaans paard.
De onderzoeksters veranderden ook het pendelcomponent. Ze bepaalden de moleculaire structuur van de peptidebindingsplaats in de pendel. Vervolgens modificeerden ze dit gebied systematisch en stapsgewijs in experimenten totdat de bindingsplaats was afgestemd op een specifiek peptide met behulp van kunstmatige aminozuren.
Versnelde evolutie
Voor deze aanpassing gebruikten de onderzoeksters methoden die biologische evolutie in razendsnel tempo nabootsen. Deze aanpak stelt ze in staat om het transportsysteem aan te passen aan een breed scala aan peptiden die onnatuurlijke aminozuren bevatten. De onderzoeksters zijn er, onder andere, ook in geslaagd om zeer omvangrijke of negatief geladen aminozuren te introduceren die voorheen helemaal niet in cellen konden worden opgenomen.
“De onnatuurlijke aminozuren zijn nu in grote hoeveelheden beschikbaar in de E. coli-cellen die het meest worden gebruikt in de biotechnologie en kunnen efficiënt in eiwitten worden ingebouwd met behulp van methoden voor genetische code-expansie”, zegt medeonderzoeker Tarun Iype.
“Dit betekent dat op maat gemaakte eiwitten met onnatuurlijke aminozuren in veel gevallen net zo efficiënt kunnen worden geproduceerd als hun natuurlijke tegenhangers”, voegt Maximilian Fottner, daar aan toe. ETH Zürich heeft een octrooi aangevraagd voor de nieuwe methode.
De methode werkt momenteel in E. coli-bacteriën. Lang: “We werken aan de ontwikkeling van een vergelijkbaar systeem in menselijke cellen. Dit zou ons in staat stellen eiwitten te produceren die alle unieke eigenschappen van menselijke cellen bevatten, waardoor ze beter geschikt zijn voor een breed scala aan therapeutische toepassingen.”
De plannen van de ETHZ-biochemici reiken verder dan aminozuren, legt Lang uit: “We willen het systeem verder ontwikkelen, zodat ook andere moleculen, die momenteel niet in cellen kunnen doordringen, in cellen kunnen worden gebracht.” Deze zouden dan bijvoorbeeld kunnen dienen als uitgangsmateriaal voor de efficiënte biotechnologische productie van complexe chemische verbindingen die voorheen alleen met grote moeite konden worden gesynthetiseerd.
Bron: idw-online.de
